Содержание
- 2. Основные сведения о топливе Топливом называются горючие вещества, которые сжигаются для получения тепла. В соответствии с
- 3. В зависимости от происхождения топливо разделяется на природное и искусственное. Природным называют топливо в том виде,
- 4. Топливо, которое по техническим и экономическим соображениям невыгодно перевозить на большие расстояния из-за его низкого качества,
- 5. Горючие газы, используемые в промышленности Горючие газы подразделяются на искусственные и природные. Искусственные газы, к которым
- 6. Схема разреза нефтегазового месторождения
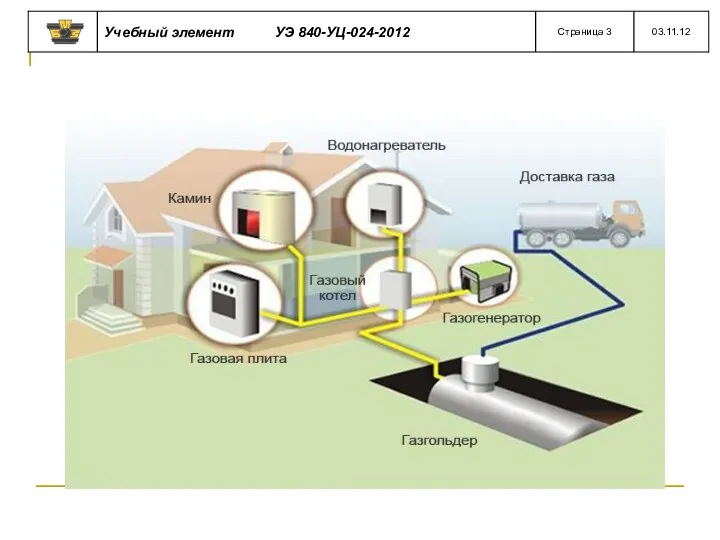
- 7. Существуют два способа снабжения потребителей природным газом: непосредственный - по газопроводам и снабжение сжиженным газом, поставляемым
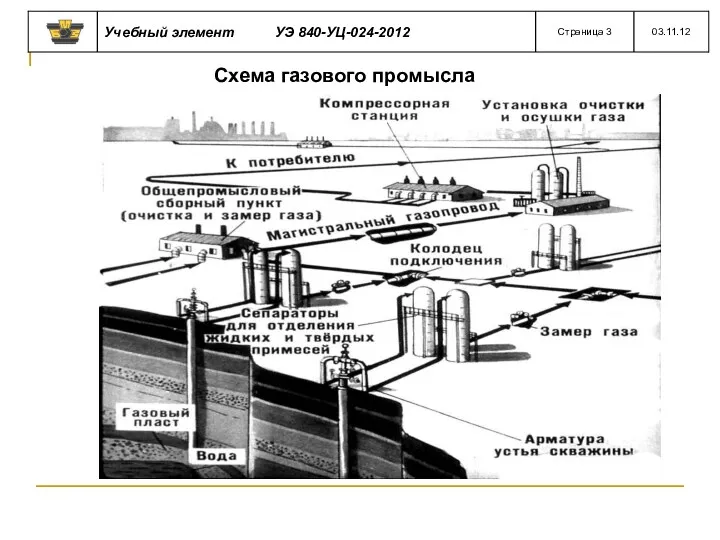
- 8. Из скважины газ направляют в газосборный пункт промысла Там его очищают, сушат и замеряют.
- 9. Природные газы перед поступлением в магистральные газопроводы очищают на специальных заводах от содержащихся в них примесей.
- 10. Схема газового промысла
- 11. Затем газ по трубам транспортируют на большие расстояния Укладка магистрального газопровода
- 13. На всем протяжении магистрального газопровода, на расстоянии примерно 150 км друг от друга, устанавливают компрессорные станции.
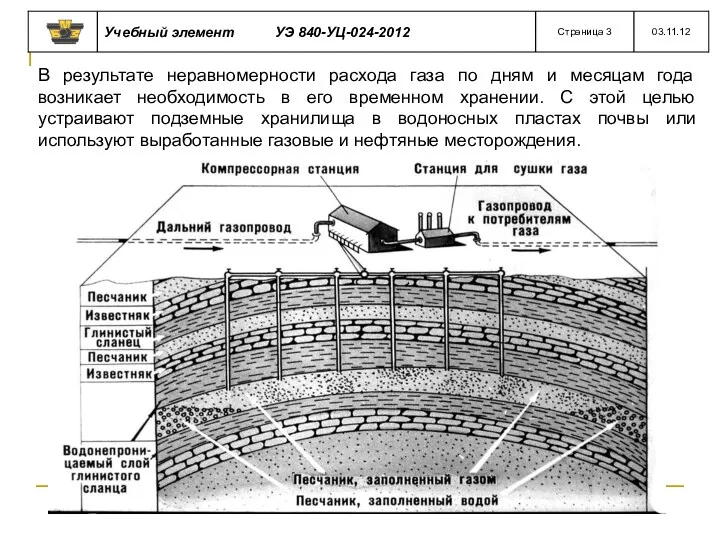
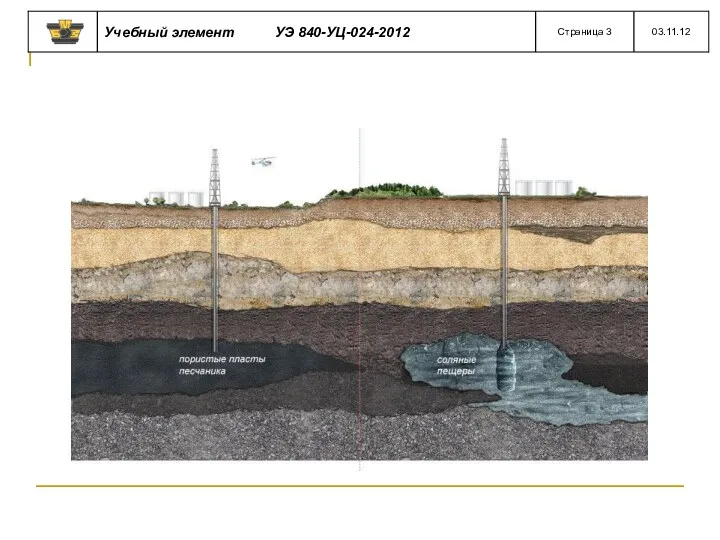
- 14. В результате неравномерности расхода газа по дням и месяцам года возникает необходимость в его временном хранении.
- 16. Небольшие количества газа хранят в газгольдерах.
- 17. Сжижение газа производится на газобензиновых заводах, откуда он в железнодорожных цистернах поступает на газораздаточные станции. Здесь
- 18. Газ в баллонах доставляют непосредственно потребителям. Из автоцистерн заполняют сжиженным газом резервуарные установки промышленных, коммунальных и
- 19. Полученную из нефтяного газа пропан – бутановую смесь сжижают и используют как топливо. Установка жидкого газа
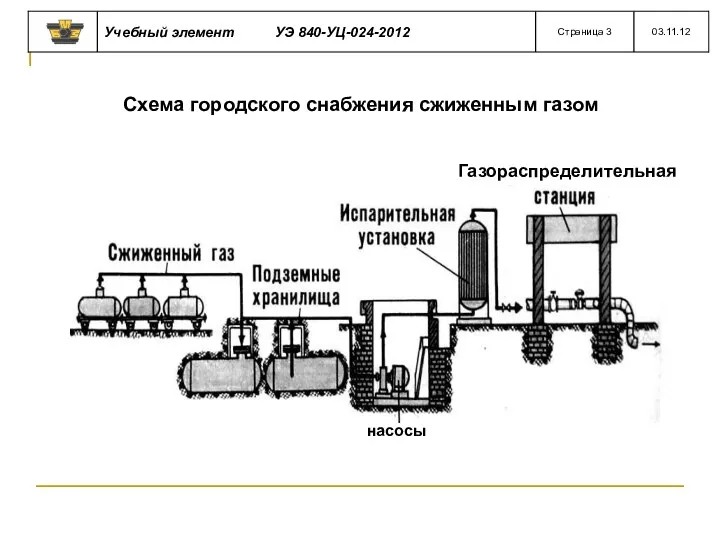
- 20. Газораспределительная Схема городского снабжения сжиженным газом насосы
- 21. Сжиженный газ по сравнению со сжатым обладает следующими преимуществами: в баллонах одинаковой емкости сжиженного газа помещается
- 22. сжиженный газ хранят в резервуарах при давлении более чем в 10 раз меньшем по сравнению со
- 23. По сравнению с природным газом сжиженный обладает рядом специфических свойств, требующих сложного оборудования для его хранения,
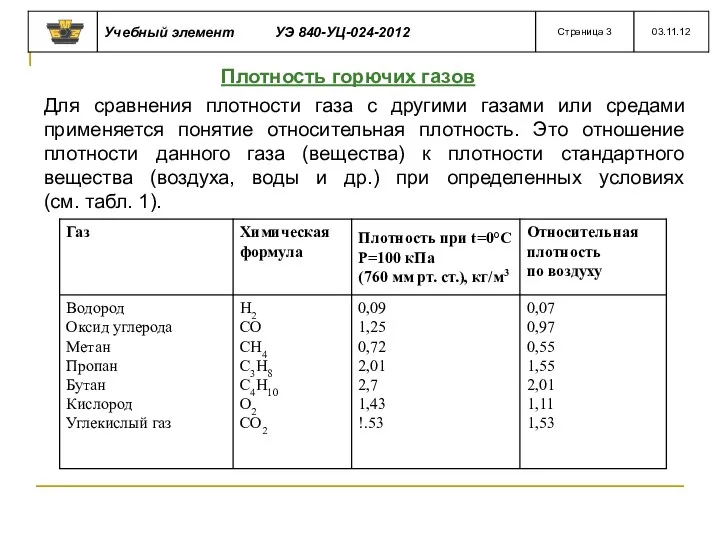
- 25. Плотность горючих газов Для сравнения плотности газа с другими газами или средами применяется понятие относительная плотность.
- 26. При относительной плотности меньше единицы газы при утечках скапливаются, прежде всего в верхней зоне помещений, а
- 27. Изменение объема жидкости в зависимости от температуры вычисляется по формуле: Vt1 = Vt2(1+k∆t) где k -
- 28. Для предупреждения случаев, приведенных в примере, баллоны заполняются не более чем на 85 % объема, не
- 29. Степень изменения объема сжиженного газа при переходе из жидкого состояния в газообразное определяется по формуле: П
- 30. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПРИРОДНЫХ ГАЗОВ У природных газов отсутствует цвет, запах, вкус. К основные показателям природных газов
- 31. Состав природного газа ( в объёмных % %) Природный газ преимущественно состоит из метана
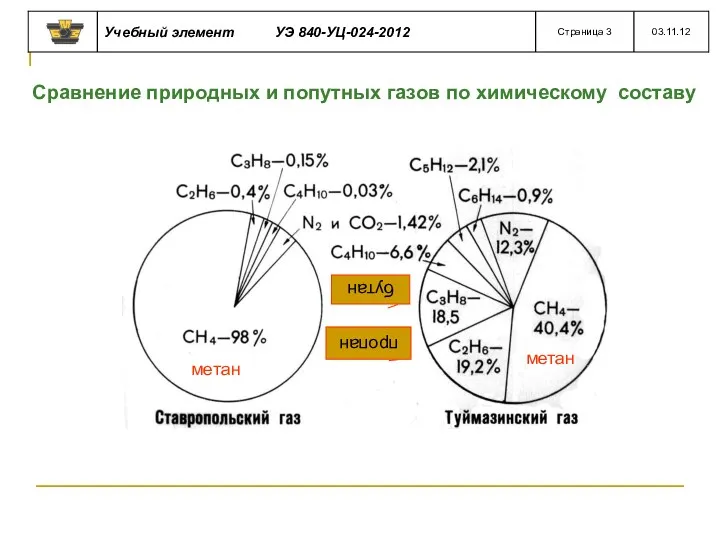
- 32. Сравнение природных и попутных газов по химическому составу метан метан пропан бутан
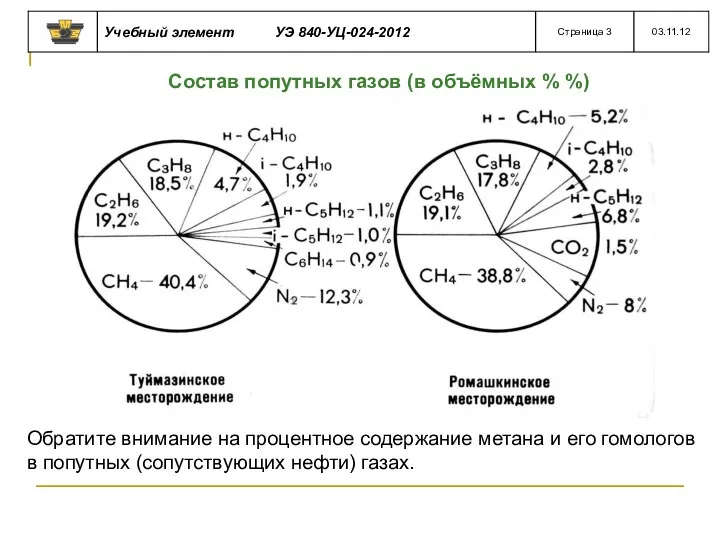
- 33. Состав попутных газов (в объёмных % %) Обратите внимание на процентное содержание метана и его гомологов
- 34. СН4 – метан С2Н 6 – этан С3Н8 – пропан С4Н10 – бутан С5Н12 - пентан
- 35. Теплота сгорания - это количество тепла, выделяемое при полном сгорании 1 м3 газа. Измеряется теплота сгорания
- 36. В расчетах в основном пользуются низшей теплотой сгорания топлива, по причине высокой температуры уходящих газов в
- 37. Условное топливо Различие теплот сгорания топлив разных видов, сортов и марок весьма велико. Так, как теплота
- 38. Поэтому для сравнения тепловой ценности различных топлив, вариантов замен одного топлива другим, составления норм расхода топлива
- 39. Важнейшей особенностью любого горючего газа является жаропроизводительность, то есть максимальная температура достигаемая при полном сгорании газа,
- 40. Величина рассчитываемая отношением массы вещества к его же объему называется плотностью вещества. Измеряется плотность в кг/м3.
- 41. Пределы воспламенения (взрыва) Наименьшее содержание горючего газа в смеси с воздухом, при котором смесь при начальной
- 42. Резкое возрастание давления и быстрое расширение продуктов горения обусловливают разрушительный эффект взрыва. Давление, возникающее при взрыве
- 43. Детонация объясняется возникновением и действием ударных волн в воспламеняющейся среде. Перемещаясь с большой скоростью, ударная волна
- 44. Наиболее опасны с точки зрения возможности взрыва газы с самыми низкими пределами взрываемости. При близких величинах
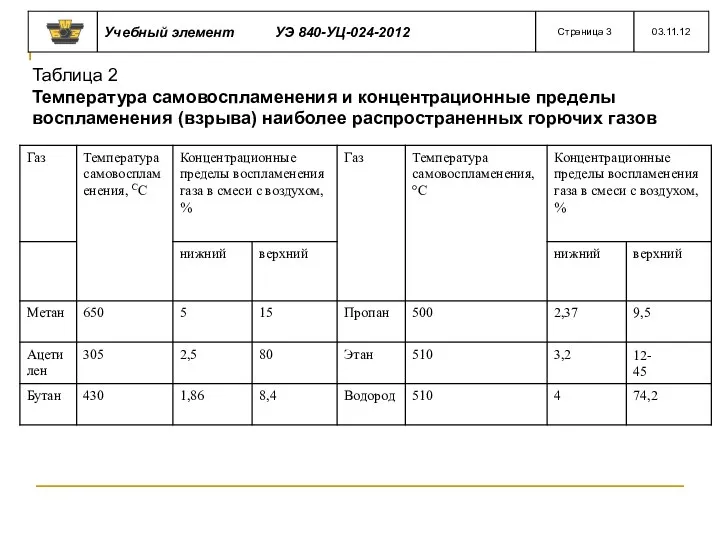
- 45. Таблица 2 Температура самовоспламенения и концентрационные пределы воспламенения (взрыва) наиболее распространенных горючих газов
- 46. У природного газа отсутствует запах. Для того чтобы определить утечку газ одоризируют (то есть придают ему
- 47. По сравнению с твердым и жидким топливом природный газ выигрывает по многим параметрам: - относительная дешевизна,
- 48. Из-за возможных утечек через неплотности в соединениях газопровода и в местах присоединения арматуры использование природного газа
- 49. Свойства отдельных составляющих природного газа (рассмотрим подробный состав природного газа) Метан (CH4) – это бесцветный газ
- 50. Бутан (C4H10) – по свойствам близок к пропану, но имеет более высокую плотность. Вдвое тяжелее воздуха.
- 51. Сероводород (H2S) – бесцветный тяжелый газ с запахом тухлых яиц. Очень ядовит, даже при очень маленькой
- 52. Метан используется как горючее в газовых плитах. Пропан и бутан – в качестве топлива в некоторых
- 53. Ацетилен используется для создания очень высокой температуры в металлургии (сверка и резка металлов). Ацетилен очень горюч,
- 54. Токсичность газового топлива и продуктов сгорания Токсичность газового топлива заключается в способности вызывать отравление человека при
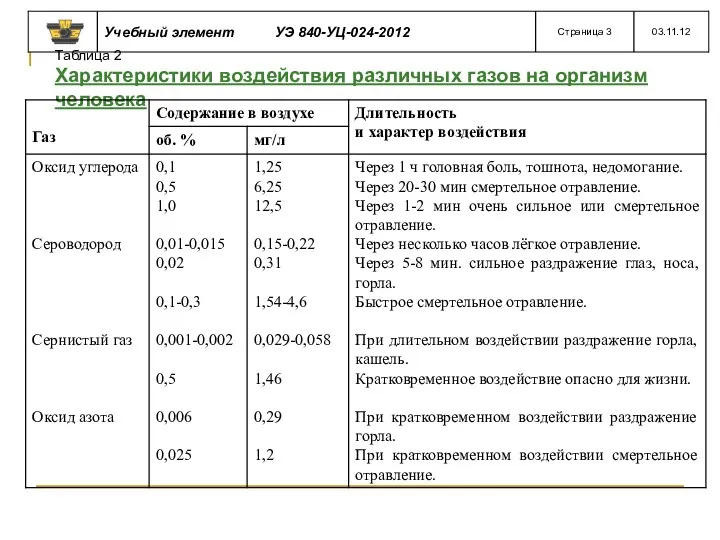
- 55. Таблица 2 Характеристики воздействия различных газов на организм человека
- 56. Сильное вредное воздействие на организм человека оказывают сероводород, оксиды серы и азота. Метан и другие углеводородные
- 57. Все углеводороды при полном окислении (избыток кислорода) выделяют углекислый газ и воду. Например: CH4 + 3O2
- 58. Метан горит голубым пламенем, этан - почти бесцветным, как спирт, пропан и бутан - жёлтым, этилен
- 60. Скачать презентацию















































 Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Catalysis. Topic 3.2
Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Catalysis. Topic 3.2 Щавелевая кислота
Щавелевая кислота Химическая связь
Химическая связь Переработка тяжелых нефтей, битумов и нефтяных остатков
Переработка тяжелых нефтей, битумов и нефтяных остатков Дистилляция в химической промышленности
Дистилляция в химической промышленности Карбоновые кислоты. Свойства карбоновых кислот
Карбоновые кислоты. Свойства карбоновых кислот Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию Соли
Соли Спектральные методы: атомная спектроскопия
Спектральные методы: атомная спектроскопия Методы сжигания газа. Раздел 3
Методы сжигания газа. Раздел 3 Дәріс тақырыбы: Кіріспе. Аналитикалық химия пәні. Сапалық талдау әдістері
Дәріс тақырыбы: Кіріспе. Аналитикалық химия пәні. Сапалық талдау әдістері Кислородные соединения углерода
Кислородные соединения углерода Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Лекарства дома
Лекарства дома Каменный уголь. Фенол
Каменный уголь. Фенол Коллигативные свойства растворов
Коллигативные свойства растворов Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Адсорбция. Раздел III
Адсорбция. Раздел III Литий. Физические свойства лития
Литий. Физические свойства лития Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ
Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ Ұшқыш уларды оқшаулауды теориялық негіздеу
Ұшқыш уларды оқшаулауды теориялық негіздеу Тяжелые металлы. Опасность токсичных металлов для организма
Тяжелые металлы. Опасность токсичных металлов для организма Медико-биологическое значение неметаллов. Йод
Медико-биологическое значение неметаллов. Йод Атомы и молекулы
Атомы и молекулы Типы химических реакций
Типы химических реакций