Содержание
- 2. УГЛЕРОД ОБРАЗУЕТ ДВА ОКСИДА CO ОКСИД УГЛЕРОДА(II) ИЛИ УГАРНЫЙ ГАЗ CO2 ОКСИД УГЛЕРОДА (IV) ИЛИ УГЛЕКИСЛЫЙ
- 3. ОКСИД УГЛЕРОДА (II) Оксид углерода (II) — сильный и очень опасный яд! . Получение. В промышленности
- 4. Физические свойства - бесцветный газ, не имеющий запаха, - плохо растворим в воде - немного легче
- 5. Горение угарного газа
- 6. ПРИМЕНЯЕТСЯ ОКСИД УГЛЕРОДА (II) ПРИ ПРОИЗВОДСТВЕ ЧУГУНА И МЕТАНОЛА
- 7. Оксид углерода (IV) Получение. Образуется при горении угля, угарного газа; в промышленности как побочный продукт при
- 8. * Физические свойства - бесцветный газ, примерно в 1,5 раза тяжелее воздуха, поэтому его можно «переливать»
- 9. ХИМИЧЕСКИЕ СВОЙСТВА Оксид углерода (IV) — типичный кислотный оксид, взаимодействует со щелочами и основными оксидами, с
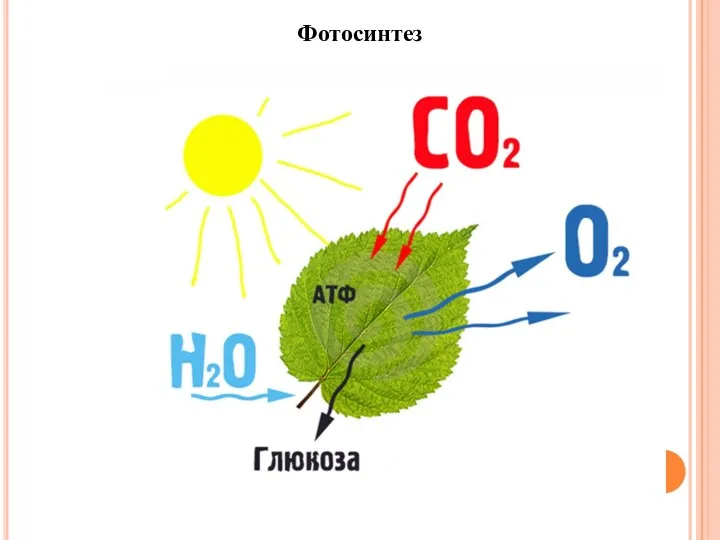
- 11. Фотосинтез
- 12. Угольная кислота – соединение крайне непрочное и распадается на CO2 и H2O уже в момент образования:
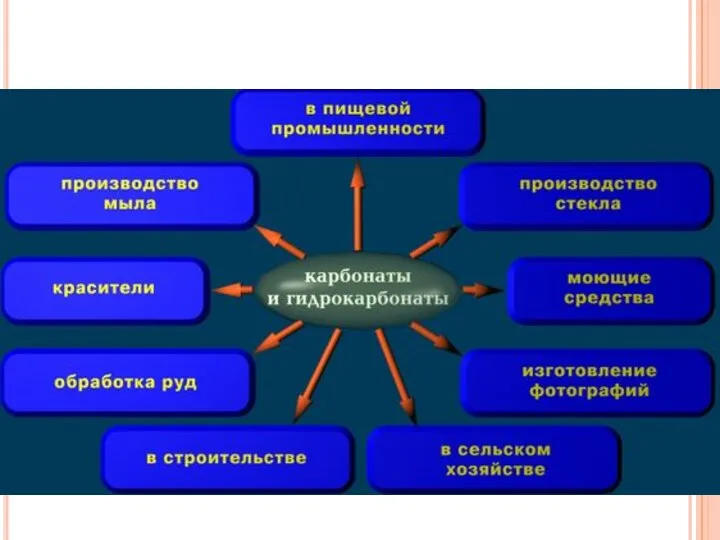
- 13. СОЛИ УГОЛЬНОЙ КИСЛОТЫ Карбонаты( CaCO3, Na2CO3) Гидрокарбонаты(Ca(HCO3)2, NaHCO3)
- 14. Применение
- 15. На земле живут три брата Из семейства карбонатов. Старший брат – красавец Мрамор, Славен именем Каррары.
- 16. Всем известен Известняк, Потому и назван так. Знаменит своим трудом, Строит он за домом дом.
- 18. Скачать презентацию













 20230814_obobshchenie_po_teme_nemetally
20230814_obobshchenie_po_teme_nemetally Биохимия и молекулярная биология. Биосинтез мембранных липидов. Лекция 9
Биохимия и молекулярная биология. Биосинтез мембранных липидов. Лекция 9 Задачі на визначення ступеню електролітичної дисоціації
Задачі на визначення ступеню електролітичної дисоціації Элемент № 24 периодической таблицы. Хром
Элемент № 24 периодической таблицы. Хром Белки – высокомолекулярные природные соединения (биополимеры)
Белки – высокомолекулярные природные соединения (биополимеры) Материаловедение. Строение вещества. Металлы и сплавы
Материаловедение. Строение вещества. Металлы и сплавы Химическая промышленность
Химическая промышленность Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Амины. Анилин
Амины. Анилин Чистые вещества и смеси
Чистые вещества и смеси Углеводы. Моносахариды. Дисахариды. Полисахариды
Углеводы. Моносахариды. Дисахариды. Полисахариды Облагораживание тяжелых нефтей и природных битумов
Облагораживание тяжелых нефтей и природных битумов Предмет химии. Вещества
Предмет химии. Вещества Задачи
Задачи Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Менделеевские уроки. День науки
Менделеевские уроки. День науки Химический элемент алюминий
Химический элемент алюминий Иодометрия. Комплексиметрия (начало)
Иодометрия. Комплексиметрия (начало) Высокомолекулярные вещества и их растворы
Высокомолекулярные вещества и их растворы Азот. Физические и химические свойства. Распространенность азота в природе. Способы получения
Азот. Физические и химические свойства. Распространенность азота в природе. Способы получения Природный и попутный нефтяной газы
Природный и попутный нефтяной газы Простые вещества. Металлы и неметаллы
Простые вещества. Металлы и неметаллы Электрохимические процессы. Лекция 7
Электрохимические процессы. Лекция 7 Вещества и их превращения Роль химии в нашей жизни
Вещества и их превращения Роль химии в нашей жизни Общая характеристика неметаллов
Общая характеристика неметаллов Физико-химические свойства органических веществ. Номенклатура, изомерия, задачи
Физико-химические свойства органических веществ. Номенклатура, изомерия, задачи Химические основы жизни
Химические основы жизни Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы