Содержание
- 2. Цели урока: Ознакомиться с понятием гидролиза солей. Рассмотреть типы гидролиза. Научиться составлять ионные уравнения гидролиза солей.
- 3. Что такое гидролиз? Гидролиз (от греческого hydro – вода; lysis – разложение) - взаимодействие органических и
- 4. Гидролиз алкенов приводит к образованию спиртов
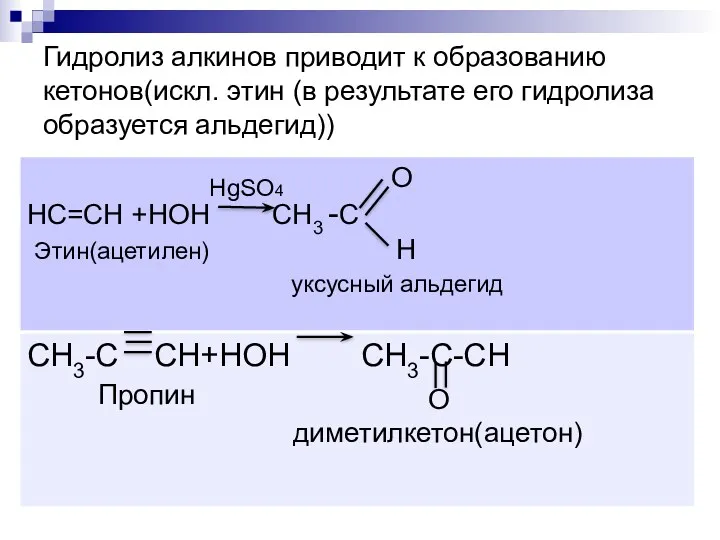
- 5. Гидролиз алкинов приводит к образованию кетонов(искл. этин (в результате его гидролиза образуется альдегид)) HgSO4 O
- 6. Гидролиз сложных эфиров(реакция, обратная этерификации) уксусная кислота
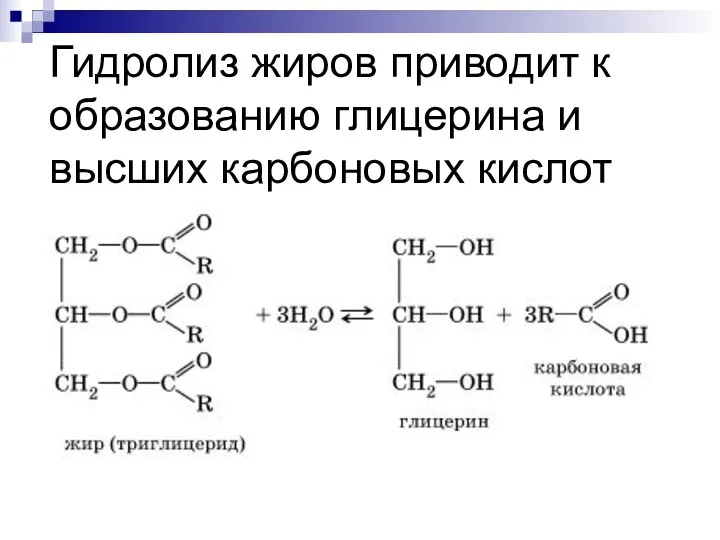
- 7. Гидролиз жиров приводит к образованию глицерина и высших карбоновых кислот
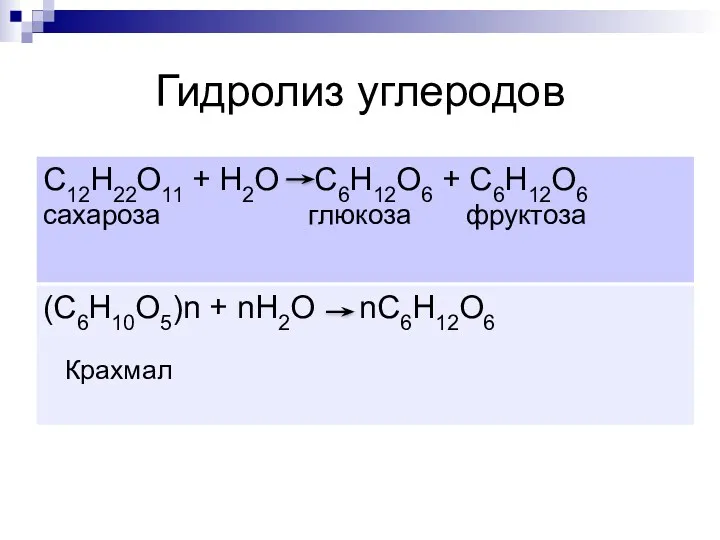
- 8. Гидролиз углеродов
- 9. Определение гидролиза Гидролиз соли – это химическая реакция обмена соли с водой, в результате которой ионы
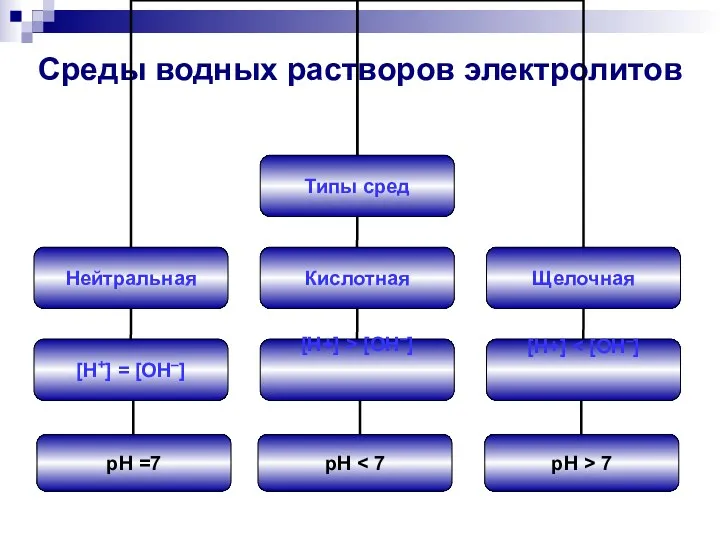
- 10. Среды водных растворов электролитов pH =7 pH pH > 7
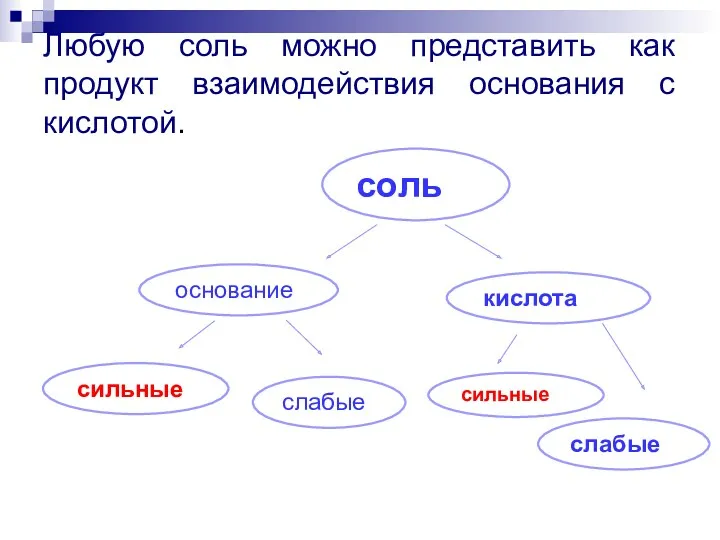
- 11. Любую соль можно представить как продукт взаимодействия основания с кислотой. соль основание кислота сильные слабые сильные
- 12. * Громова О.И Электролиты сильные: NaOH, KOH, H2SO4, HNO3, HClO4, HCl, HMnO4, HI, HBr; слабые: ,
- 13. 1. Классификация солей 2.Соли, образованные сильной кислотой и слабым основанием (AlCl3, FeSO4, Mn(NO3)2.) 1. Соли, образованные
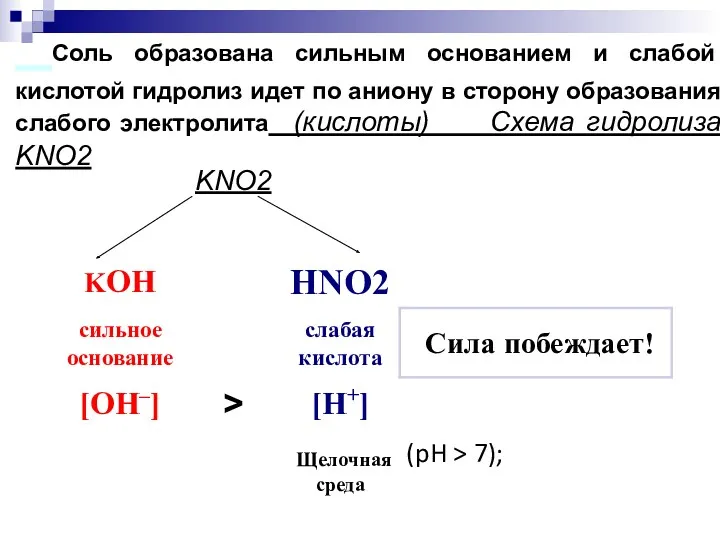
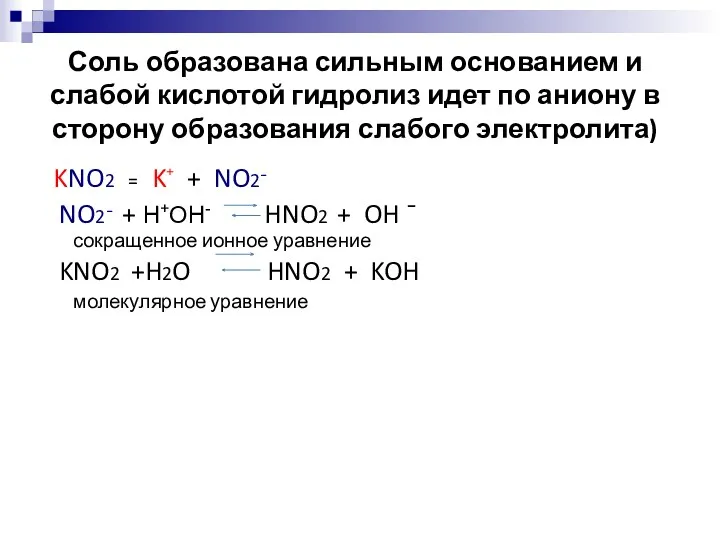
- 14. Соль образована сильным основанием и слабой кислотой гидролиз идет по аниону в сторону образования слабого электролита
- 15. Соль образована сильным основанием и слабой кислотой гидролиз идет по аниону в сторону образования слабого электролита)
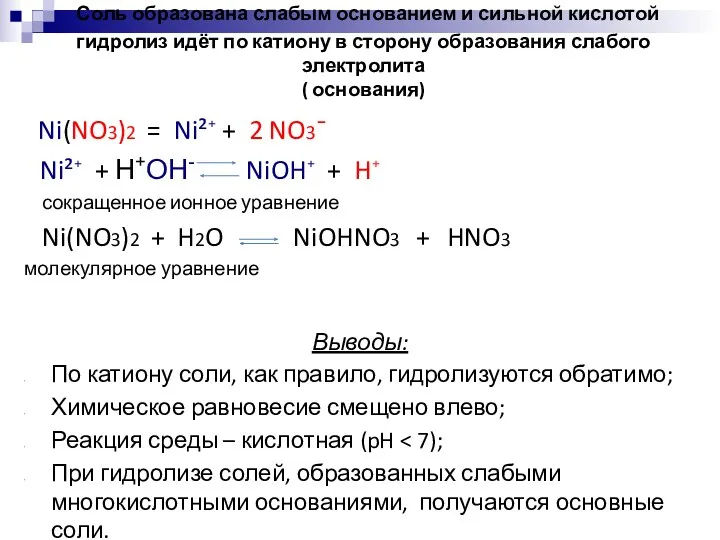
- 16. Выводы: По аниону соли, как правило, гидролизуются обратимо; Химическое равновесие смещено влево; Реакция среды – щелочная
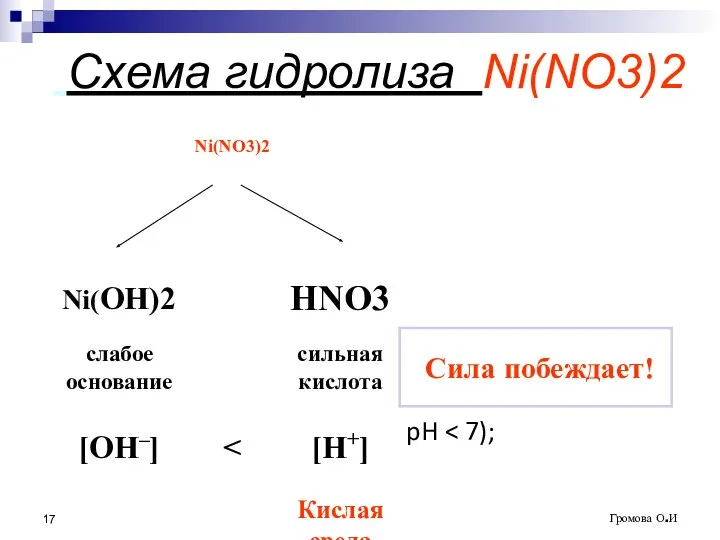
- 17. * Громова О.И Схема гидролиза Ni(NO3)2
- 18. Соль образована слабым основанием и сильной кислотой гидролиз идёт по катиону в сторону образования слабого электролита
- 19. Схема гидролиза Al2S3
- 20. * Громова О.И Уравнения гидролиза Al2S3 Al2S3 + 6H2O-->2Al(OH)3 + 3H2S Гидролиз по катиону и аниону.
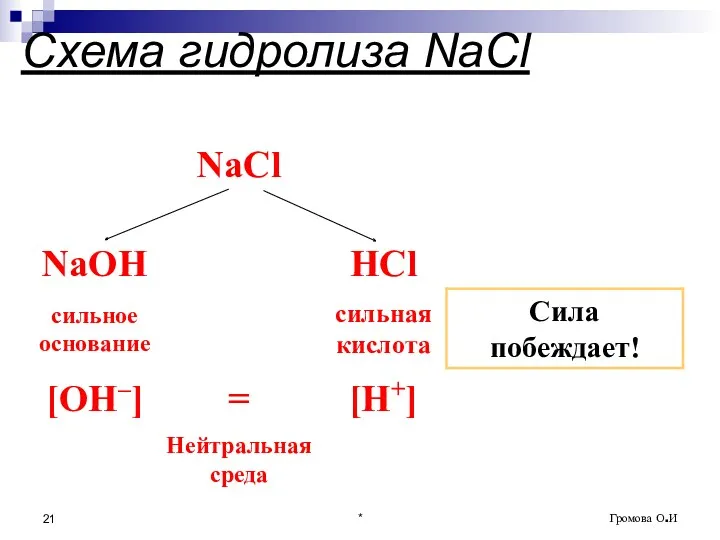
- 21. * Громова О.И Схема гидролиза NaCl
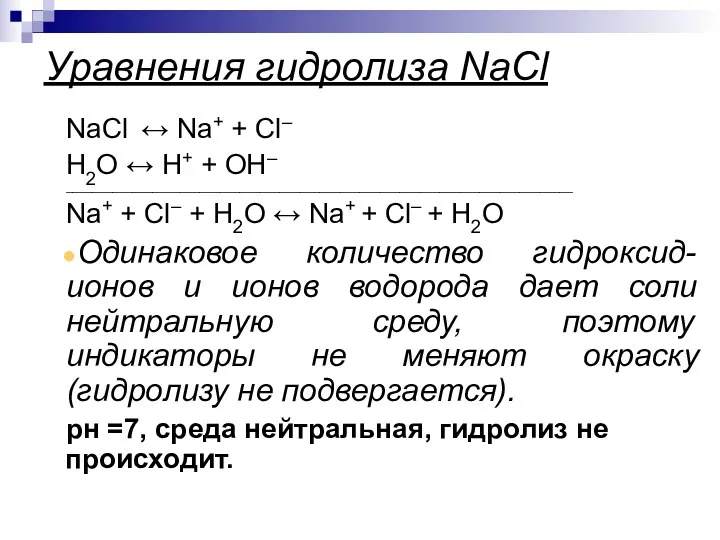
- 22. Уравнения гидролиза NaCl NaCl ↔ Na+ + Сl– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ Na+ +
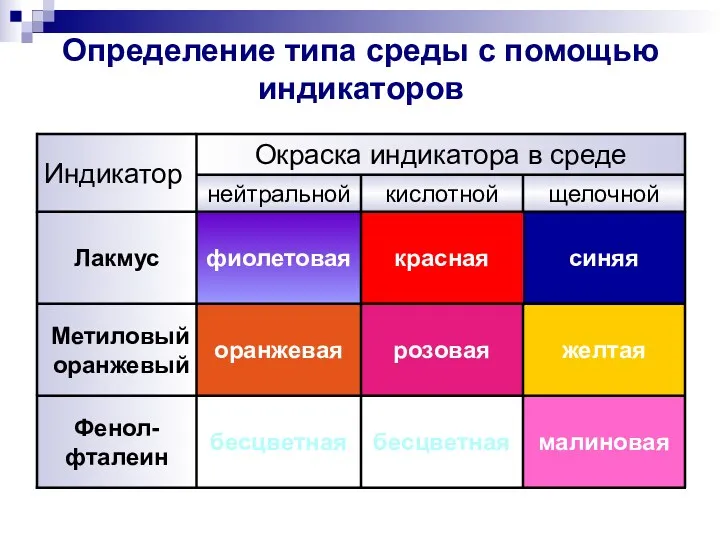
- 24. Определение типа среды с помощью индикаторов синяя красная фиолетовая Лакмус малиновая бесцветная бесцветная Фенол- фталеин желтая
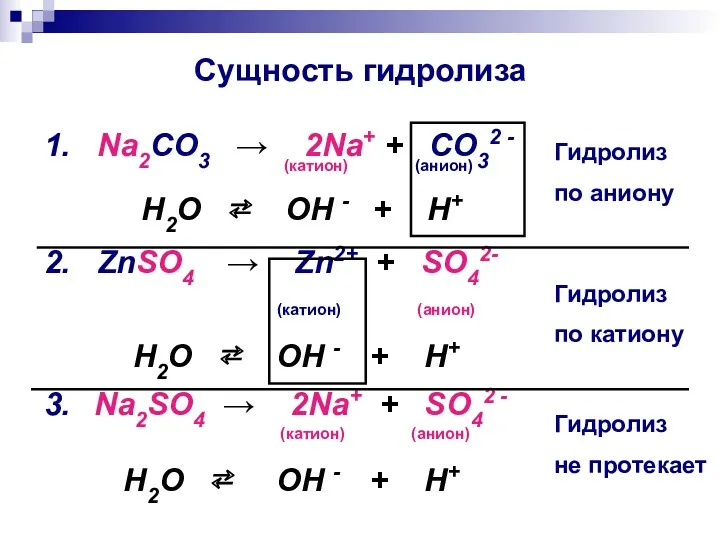
- 26. Сущность гидролиза 1. Na2CO3 → 2Na+ + CO32 - (катион) (анион) H2O ⇄ OH - +
- 27. Уравнения гидролиза ← Na2CO3 → NaOH сильное основание H2CO3 слабая кислота Na2CO3 → 2Na+ + CO32
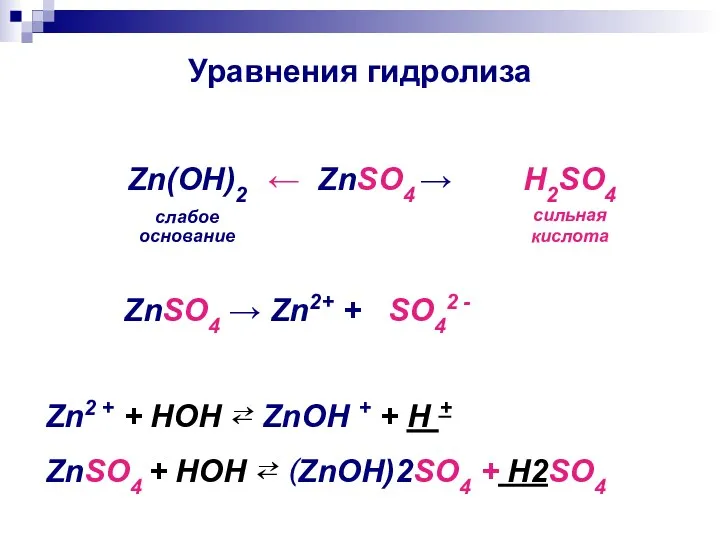
- 28. Уравнения гидролиза ← ZnSO4 → Zn(ОН)2 слабое основание H2SO4 сильная кислота ZnSO4 → Zn2+ + SO42
- 29. Задание. Определите реакцию среды водных растворов солей. Таблица № 2 NaNO3 K2S Na2SiO3 5. NH4NO3 LiNO3
- 30. * Громова О.И Выполните следующие задания 1.Составьте ионное и молекулярные уравнение гидролиза этих солей а) нитрата
- 31. Выполните задание 2. Установите соответствие: Формула соли Тип гидролиза 1. FeCl2 А. по катиону 2. Ba(NO3)2
- 33. Скачать презентацию
















 Алкадиены, нафтены
Алкадиены, нафтены Аминокислоты
Аминокислоты Биологически важные пяти- и шестичленные гетероциклы с одним и двумя гетероатомами
Биологически важные пяти- и шестичленные гетероциклы с одним и двумя гетероатомами Серная кислота
Серная кислота Фізичні та хімічні властивості кислот (урок хімії у 8 класі)
Фізичні та хімічні властивості кислот (урок хімії у 8 класі) Типы химических реакций , признаки и условия их протекания
Типы химических реакций , признаки и условия их протекания Физико-химия полимеров и их растворов
Физико-химия полимеров и их растворов Азот
Азот Хімічні властивості кислот
Хімічні властивості кислот Поширення солей у природі
Поширення солей у природі Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия ПЛАСТИК НОВЫЙ
ПЛАСТИК НОВЫЙ Stirring in liquid media
Stirring in liquid media Литий
Литий Липиды (Жиры)
Липиды (Жиры) В чём соль соли
В чём соль соли Классификация химических реакций по различным основаниям. 9 класс
Классификация химических реакций по различным основаниям. 9 класс Технологии получения полимерных нанокомпозитов
Технологии получения полимерных нанокомпозитов Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Правила роботи на уроці
Правила роботи на уроці Задачи на процентную концентрацию
Задачи на процентную концентрацию Углероды. Строение и свойства атомов
Углероды. Строение и свойства атомов Спирт µндіру технологиясы
Спирт µндіру технологиясы Решение заданий по теме: Оксиды
Решение заданий по теме: Оксиды Основная. Первоначальные представления об органических веществах
Основная. Первоначальные представления об органических веществах Химические свойства серной кислоты
Химические свойства серной кислоты Никель қаптамаларын алу жолдары
Никель қаптамаларын алу жолдары Полистирол өндірісі
Полистирол өндірісі