Содержание
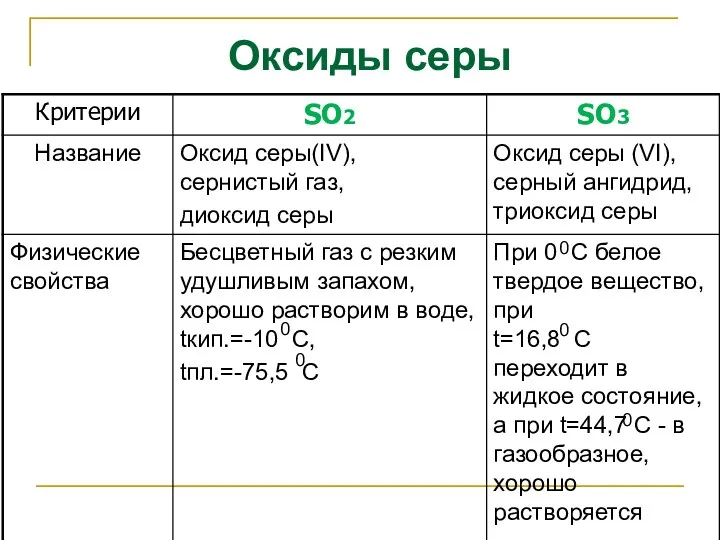
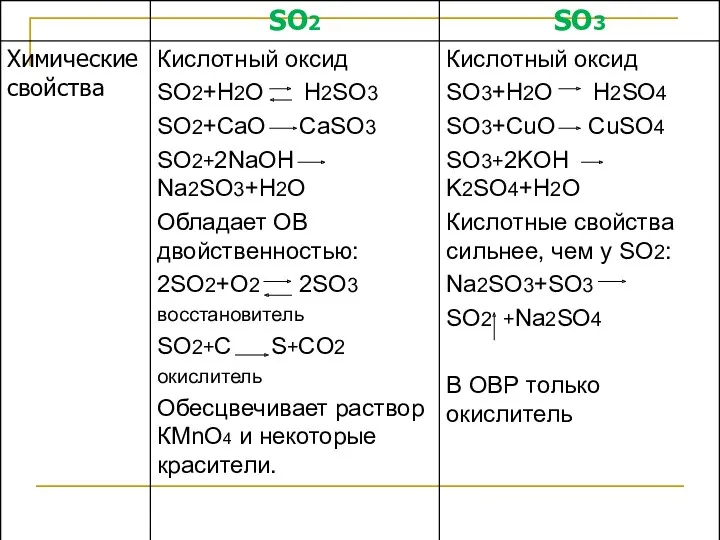
- 2. Оксиды серы 0 0 0 0 0
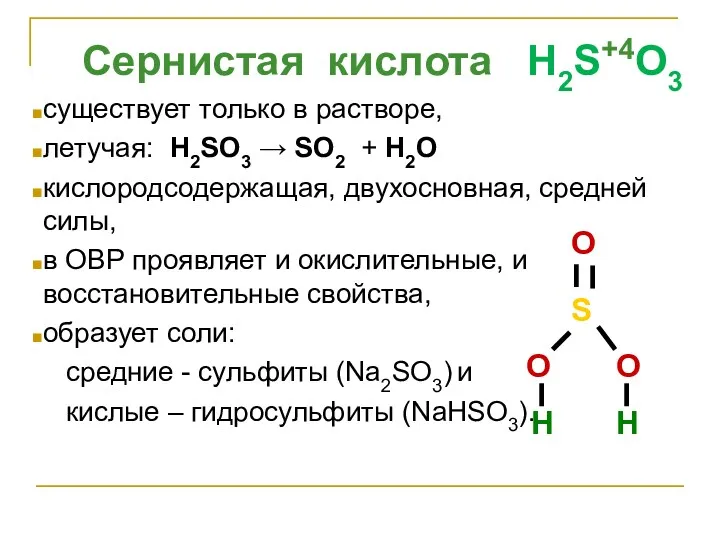
- 4. Сернистая кислота H2S+4O3 существует только в растворе, летучая: H2SO3 → SO2 + H2O кислородсодержащая, двухосновная, средней
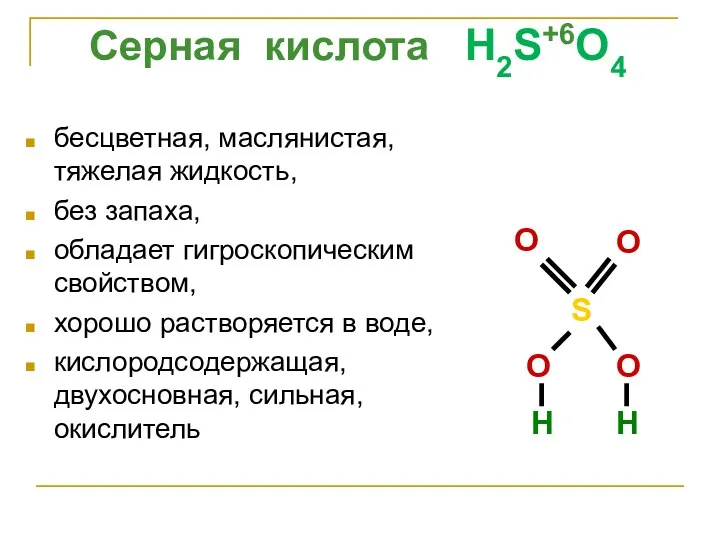
- 5. бесцветная, маслянистая, тяжелая жидкость, без запаха, обладает гигроскопическим свойством, хорошо растворяется в воде, кислородсодержащая, двухосновная, сильная,
- 6. S, H2S, FeS2 → SO2 → SO3 → H2SO4 1-я стадия. Печь для обжига колчедана. Получение
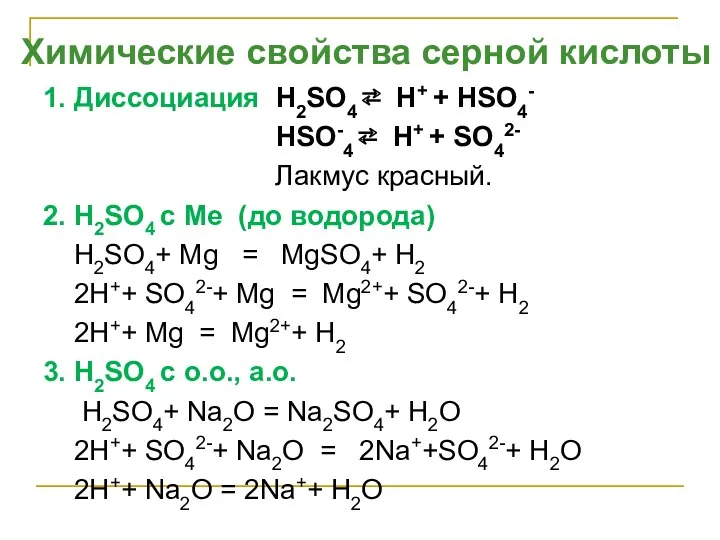
- 7. 1. Диссоциация H2SO4 ⇄ H+ + НSO4- HSO-4 ⇄ H+ + SO42- Лакмус красный. 2. H2SO4
- 8. 4. H2SO4 с основаниями H2SO4+2NaOH = Na2 SO4+ 2H2O 2H+ + SO42-+ 2Na+ + 2OH- =2Na++SO42-+
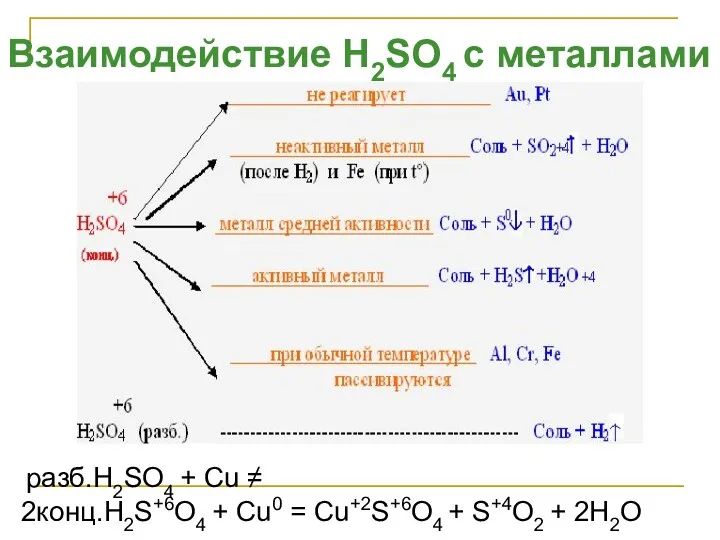
- 9. Взаимодействие H2SO4 с металлами разб.H2SO4 + Cu ≠ 2конц.H2S+6O4 + Cu0 = Cu+2S+6O4 + S+4O2 +
- 10. C12H22O11(сахароза)+H2SO4 →12С(уголь) +H2SO4 *11H2O Органические вещества обугливаются !!! C + 2H2SO4 = CO2 + 2SO2 +
- 11. Применение серной кислоты - в производстве минеральных удобрений; - как электролит в свинцовых аккумуляторах; - в
- 13. Сумма всех электронов (SO3)= 16+8*3= 40 Сумма всех электронов (Н2SO4)= 1*2+16+8*4= 50
- 15. S+ Ме S+ НеМе S в воде не растворяется, не смачивается
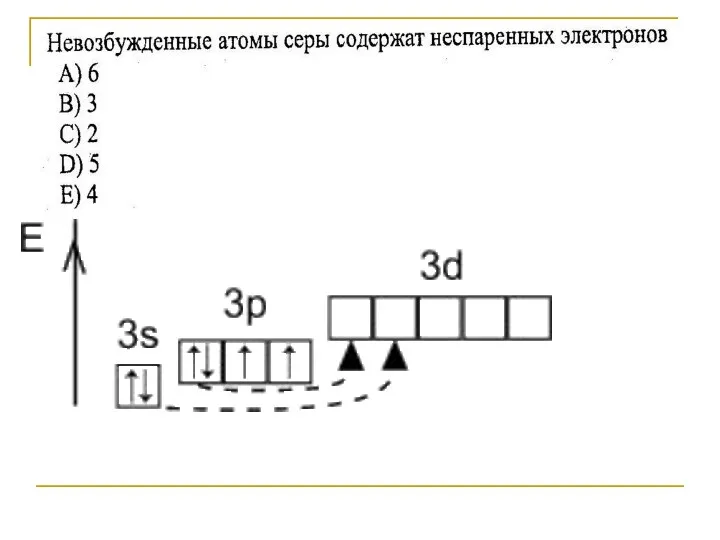
- 16. S-2 → только восстановители S0 → окислители, восстановители S+4 → окислители, восстановители S+6 → только окислители
- 18. H2SO4 ⇄ H+ + НSO4- гидросульфат-ион HSO-4 ⇄ H+ + SO42- сульфат-ион Соли: гидросульфаты, сульфаты.
- 19. Са(ОН)2 ⇄ СаОН+ + ОН- 2Са(ОН)2 + Н2SО4 = (СаОН)2SО4 + 2Н2О 2 + 1+ 1
- 20. Серная кислота реагирует с металлами (до Н), основными и амфотерными оксидами, основаниями. Ответ: А.
- 22. Скачать презентацию












 Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов 20231113_tipy_him._reaktsiy_prezentatsiya
20231113_tipy_him._reaktsiy_prezentatsiya Физико-химические свойства поливинилового спирта и поливинилформаля
Физико-химические свойства поливинилового спирта и поливинилформаля Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Наглядное пособие Динамические модели. Химическое равновесие в растворах
Наглядное пособие Динамические модели. Химическое равновесие в растворах Total Synthesis of Aplysiasecosterol A
Total Synthesis of Aplysiasecosterol A Химико-лесной комплекс
Химико-лесной комплекс Металлы в организме человека
Металлы в организме человека Тепловой эффект химических реакций
Тепловой эффект химических реакций Полімери. Будова і властивості полімерів
Полімери. Будова і властивості полімерів Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Занимательные опыты в качественном анализе
Занимательные опыты в качественном анализе Атомы и молекулы. Простые и сложные вещества. 6 класс
Атомы и молекулы. Простые и сложные вещества. 6 класс Пниктогены - элеметны VA группы
Пниктогены - элеметны VA группы Соли. Классификация. Физические и химические свойства солей
Соли. Классификация. Физические и химические свойства солей Теория электролитической диссоциации
Теория электролитической диссоциации Производство чугуна и стали
Производство чугуна и стали Основания. 8 класс
Основания. 8 класс Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Строение атома. Лекция №2
Строение атома. Лекция №2 Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию АТФ молекуласының құрылысы мен қызметтері
АТФ молекуласының құрылысы мен қызметтері Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс)
Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс) Спирты. Действие этанола на организм человека (10 класс)
Спирты. Действие этанола на организм человека (10 класс) Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Електроліти в сучасних акумуляторах
Електроліти в сучасних акумуляторах Химия воды
Химия воды