Содержание
- 2. Определение Соли - сложные вещества, состоящие из атома металла и кислотного остатка (иногда содержат водород).
- 3. Это интересно! 5-6 тысяч лет тому назад египтяне заделывали швы сложенных из камней пирамид гипсом. Такие
- 4. Классификация солей КОМПЛЕКСНЫЕ Na[Al(OH)4]; K4[Fe(CN)6]
- 5. Средние соли Соли средние или нормальные - это сложные вещества, состоящие из катионов металлов и анионов
- 6. Применение некоторых солей в быту Во всех аптечках есть перманганат калия KMnO4 (марганцовка), которая используется как
- 7. Соли в живых организмах Фосфат кальция Ca3(PO4)2 содержится в костях. Хлорид натрия NaCl необходимо добавлять в
- 8. Кислые соли Кислые соли - продукты неполного замещения атомов водорода в кислоте химическим элементом металлом (в
- 9. Это интересно! Немецкий химик Ю. Либих изобрел не только бульонные кубики, но и порошок для получения
- 10. Основные соли Основные соли - продукты неполного замещения гидроксогрупп в гидроксиде металла кислотными остатками (катион содержит
- 11. Классификация солей Двойные соли – соли, содержащие два катиона KAl(SO4)2 Смешанные соли – соли, содержащие два
- 12. Комплексные соли Na[Al(OH)4]; K4[Fe(CN)6] Комплексными солями являются известные вам реактивы на: ионы Fe2+ − красная кровяная
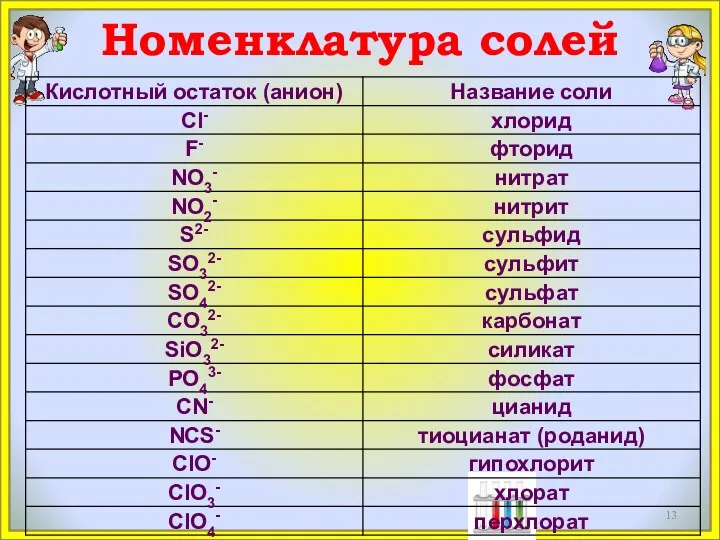
- 13. Номенклатура солей
- 14. Проверь себя Формулы двух кислых солей приведены в паре: NaCl и CuOHCl KHSO3 и H2SO3 CuSO4
- 15. Проверь себя Формулы двух основных солей приведены в паре: (CuOH)2CO3 и CuOHCl KHSO3 и KOH CaCl2
- 16. Проверь себя Установите соответствие между формулой соли и её принадлежностью к определённой группе. А) ZnSO4 1)
- 17. ФИЗИЧЕСКИЕ СВОЙСТВА Соли - твердые кристаллические вещества. Многие вещества имеют высокие температуры плавления и кипения. По
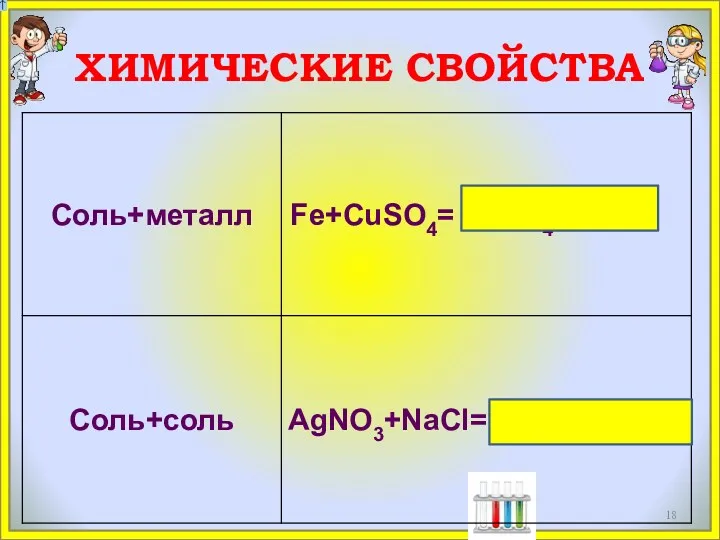
- 18. ХИМИЧЕСКИЕ СВОЙСТВА
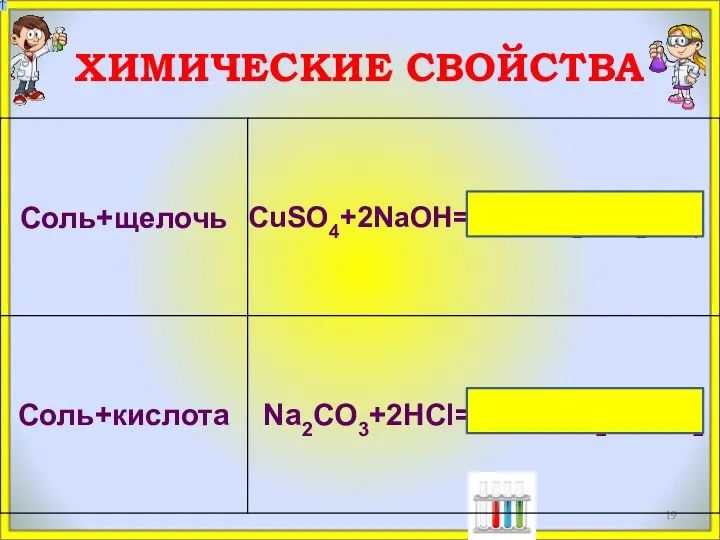
- 19. ХИМИЧЕСКИЕ СВОЙСТВА
- 20. Генетическая связь между классами неорганических веществ Между оксидами, кислотами, основаниями и солями имеется глубокая связь. Зная
- 21. Способы получения средних солей Основания + кислота: 3NaOH + H3PO4 = Na3PO4 + 3H2O Основный оксид
- 22. Способы получения средних солей Соль + кислота: BaCl2 + H2SO4 = BaSO4↓ + 2HCl Раствор соли
- 23. Способы получения средних солей Металл + неметалл: Mg + S = MgS Металл + раствор соли:
- 24. Получение кислых солей Взаимодействие избытка кислоты с основанием: H3PO4 + NaOH = NaH2PO4 + H2O Взаимодействие
- 25. Проверь себя Установите соответствие между реагирующими веществами и продуктами из взаимодействия. А) KOH + SO3(изб) →
- 26. Получение основных солей Взаимодействие кислоты с избытком основания: Fe(OH)3 + HCl = Fe(OH)2Cl + H2O Взаимодействие
- 27. Соли в природе (карбонаты) мел состоит из раковин вымерших одноклеточных организмов. Раковины моллюсков, скорлупа птичьих яиц,
- 28. Соли в природе (карбонаты) В интересной и причудливой форме встречается карбонат кальция в пещерах. Это возможно
- 29. Соли в природе (карбонаты) Мрамор— кристаллическая метаморфическая горная порода, образовавшаяся в результате перекристаллизации известняка или доломита
- 30. Соли в природе (хлориды) Хлорид натрия — минерал галит. Может иметь белую, розовую или синюю окраску.
- 31. Соляной купол Ходжа-Мумин в Таджикистане Высота 900 м, площадь 40 км2 Соляная пещера Мальхам Протяженность 5,5
- 32. Соли в природе (сульфаты) Сульфаты являются основной составной частью минерала гипса CaSO4⋅2H2O И мирабилита Na2SO4⋅10H2O. залив
- 33. Соли в природе (фосфаты) Са3(РО4)2 - минерал фосфорит, минерал апатит содержит кроме Са3(РО4)2 еще CaF2 или
- 35. Скачать презентацию


![Классификация солей КОМПЛЕКСНЫЕ Na[Al(OH)4]; K4[Fe(CN)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/360600/slide-3.jpg)







![Комплексные соли Na[Al(OH)4]; K4[Fe(CN)6] Комплексными солями являются известные вам реактивы](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/360600/slide-11.jpg)


















 Дисперсные системы. 11 класс
Дисперсные системы. 11 класс Значення періодичного закону
Значення періодичного закону Химические свойства металлов
Химические свойства металлов Apa în natură. Resursele de apă
Apa în natură. Resursele de apă Азот и его соединения
Азот и его соединения Азотсодержащие органические соединения. Лекция 8
Азотсодержащие органические соединения. Лекция 8 Валентность химических элементов (8 класс)
Валентность химических элементов (8 класс) Закон збереження маси речовини. Хімічні рівняння
Закон збереження маси речовини. Хімічні рівняння Соли. Классификация
Соли. Классификация Арилалкиламины, гидроксифенилалкиламины и их производные
Арилалкиламины, гидроксифенилалкиламины и их производные Природные источники углеводородов
Природные источники углеводородов Особенности строения твердых тел
Особенности строения твердых тел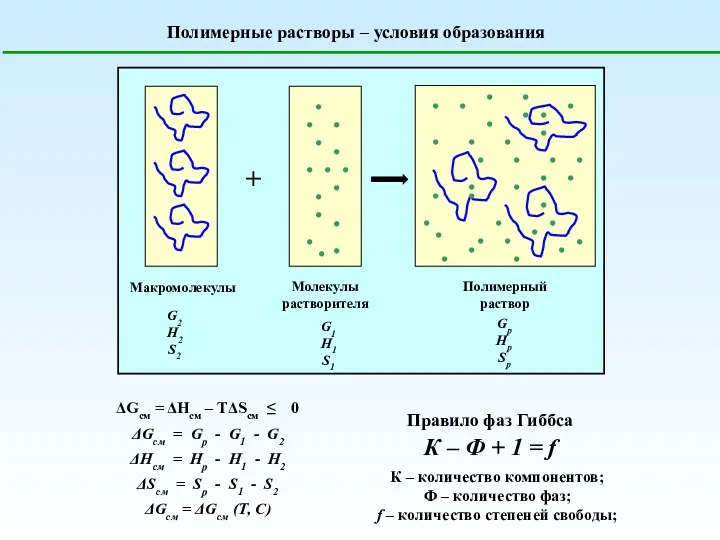 Полимерные растворы. Условия образования
Полимерные растворы. Условия образования Радиусы атомов и ионов
Радиусы атомов и ионов Кристаллофизика_часть_1
Кристаллофизика_часть_1 20230209_pshe_i_svoystva_elementov
20230209_pshe_i_svoystva_elementov Хром и его соединения
Хром и его соединения Гідроліз солей
Гідроліз солей Sulfur and its compounds. Contact method for producing sulfuric acid
Sulfur and its compounds. Contact method for producing sulfuric acid Липиды. Классификация
Липиды. Классификация Вода. Состав и строение молекулы
Вода. Состав и строение молекулы Обратимость химических реакций. Химическое равновесие и способы его смещения
Обратимость химических реакций. Химическое равновесие и способы его смещения Маңызды химиялық өндірістер
Маңызды химиялық өндірістер Химическая связь и строение химических соединений
Химическая связь и строение химических соединений Количественное определение лекарственных веществ
Количественное определение лекарственных веществ Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою Свойства и применение железа
Свойства и применение железа Углеводы. Сn(H2O)m – общая формула углеводов
Углеводы. Сn(H2O)m – общая формула углеводов