Содержание
- 2. Гідроліз – це реакція обмінного розкладання речовини водою. Гідроліз солей
- 3. 1. Гідроліз галогеналканов. С2Н5Сl + Н2О →С2Н5ОН + НСl 2. Гідроліз складних ефірів. СН3-СОО-С2Н5 + Н2О
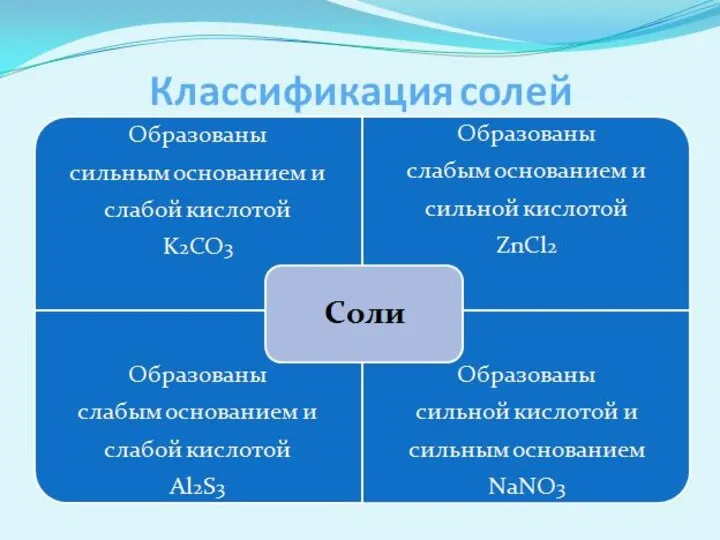
- 4. Гидролизу подвергаются растворы солей. Следовательно, водные растворы солей имеют разные значения рН и различные типы сред:
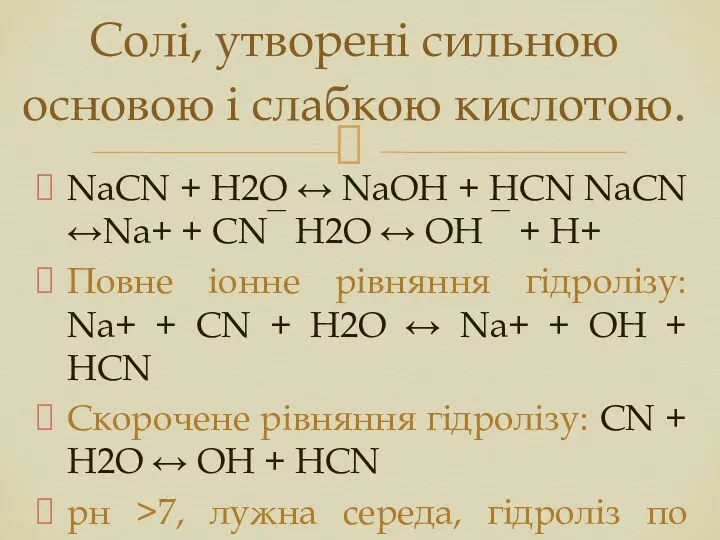
- 6. NaCN + Н2О ↔ NaOH + HCN NaCN ↔Na+ + CN‾ Н2О ↔ OH ‾ +
- 7. Гідроліз по аніону: Оборотний процес. Хімічна рівновага зміщена вліво. Реакція середовища лужна, рН>7. При гідролізі солей,
- 8. NH4Cl + H2O ↔ NH3·Н2О + НСl NH4Cl ↔ NH4+ + Cl Н2О ↔ OH +
- 9. Гідроліз по катиону: Оборотний процес. Хімічна рівновага зміщена вліво. Середа кислотна, рН Солі, утворені сильною кислотою
- 10. NH4СН3СОО + H2O ↔ СН3СООН + NH3 · Н2О NH4СН3СОО ↔ NH4 + + СН3СОО Н2О
- 11. Гідроліз по катиону і по аніону. Хімічна рівновага зміщена вправо. Реакція середовища або нейтральна або слабокисла,
- 12. КСl + H2O ↔ КСl ↔ До + + Сl Н2О ↔ OH + H +
- 13. Гідроліз можна підсилити: Додати води. Нагріти розчин (збільшиться дисоціація води). Зв'язати один з продуктів гідролізу в
- 14. Гідроліз можна придушити. Збільшити концентрацію розчиненої речовини. Охолодити розчин. Ввести в розчин один з продуктів гідролізу:
- 15. Тести на тему: Гідроліз солей 1. Водний розчин речовини А має нейтральне середовище, а водний розчин
- 16. 3. Газ виділяється при змішуванні розчинів хлориду хрому(III): гидросульфида амонію; гидроортофосфата калію; гідросульфату натрію; силікату натрію.
- 17. 7. Цинк буде розчинятися при зануренні її в розчин: хлориду натрію; хлориду барію; хлориду алюмінію; хлориду
- 18. Відповіді до тесту 1)а, б 2)г 3)а 4)г 5)в,г 6)б,г 7)в 8)в 9)а 10)в
- 19. Задачі 1. До 50 г розчину карбонату натрію з масовою часткою розчиненої речовини 10,6% прилили надмірна
- 21. Скачать презентацию
















 Ароматические амины
Ароматические амины Природные и химические волокна
Природные и химические волокна Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Химические свойства алкенов
Химические свойства алкенов Диэлектрофорез: движение клеток или частиц в неоднородном переменном электрическом поле
Диэлектрофорез: движение клеток или частиц в неоднородном переменном электрическом поле Растворы электролитов. Ионизация воды и шкала рН
Растворы электролитов. Ионизация воды и шкала рН Химический элемент и вещество
Химический элемент и вещество Летучие органические соединения (ЛОС)
Летучие органические соединения (ЛОС) Вуглецьвмісна сировина для одержання вуглецевих сорбентів
Вуглецьвмісна сировина для одержання вуглецевих сорбентів Бытовая химия
Бытовая химия Кристаллические решетки. (8 класс)
Кристаллические решетки. (8 класс) Сера и её соединения
Сера и её соединения Обмен жиров
Обмен жиров Изомерия. (11 класс)
Изомерия. (11 класс) Такой разный песок
Такой разный песок Роль полимеров в нашей жизни
Роль полимеров в нашей жизни Реакции нейтрализации
Реакции нейтрализации Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Кинетика и равновесие химических реакций
Кинетика и равновесие химических реакций Аминокислоты и белки
Аминокислоты и белки Синтетические моющие средства
Синтетические моющие средства Количество вещества. Единица измерения вещества моль
Количество вещества. Единица измерения вещества моль Камни и Лев
Камни и Лев Химия көшбасшысы
Химия көшбасшысы Қышқылдық-негіздік тепе-теңдік. Қышқылдар мен негіздердің протологиялық теориясы
Қышқылдық-негіздік тепе-теңдік. Қышқылдар мен негіздердің протологиялық теориясы Металдардың физикалық қасиеттерін ажырата білу
Металдардың физикалық қасиеттерін ажырата білу XXI ғасыр көшбасшысы
XXI ғасыр көшбасшысы Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении