Содержание
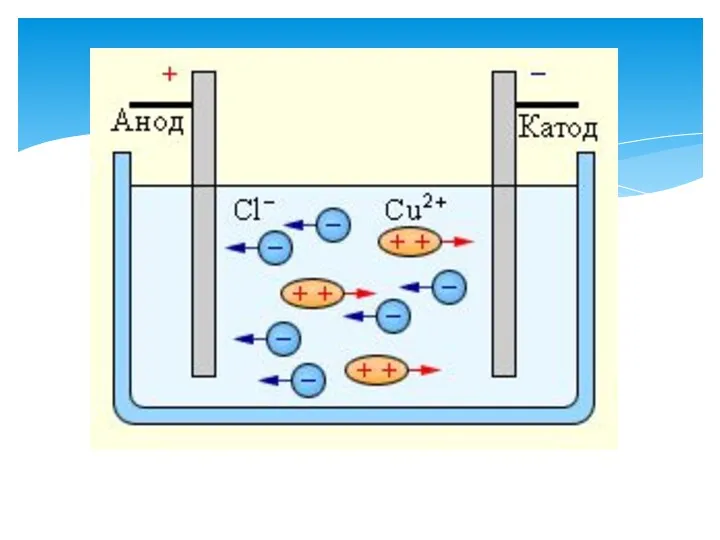
- 2. -(10.1В) тотықсыздану бұл сутегінің қосылуы немесе оттегінің жойылуы екендігін білу -(10.1В) тотығуға және тотықсыздануға қатысты иондық-электрондық
- 3. (10.1С) Қазақстан Республикасында жүзеге асырылатын негізгі өндірістерді және өндірістік процестерді білу (10.1С) күкірт қышқылы өндірісінің процесін
- 4. Жетістік критерийлері: -тотығуға және тотықсыздануға қатысты иондық-электрондық жартылай реакциялар теңдеулерін анықтай және жаза алады; -элементтердің тотығу
- 5. Zn + 2HCl → ZnCl2 + H2 CuSO4 +2NaOH → Cu(OH)2↓ + Na2SO4 Мына берілген реакция
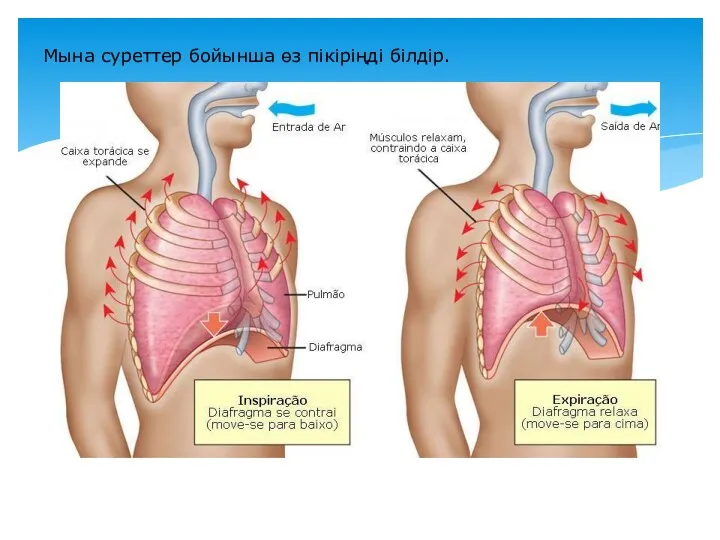
- 6. Мына суреттер бойынша өз пікіріңді білдір.
- 13. 1. Молекулаарлық тотығу – тотықсыздану реакциялары Fe + CuSO4 → Cu + FeSO4 2. Молекулаішілік тотығу–
- 14. Қалыптастырушы жұмыс
- 15. Қазақстан Республикасындағы негізгі өндіріс орындары және өндірістік процестер
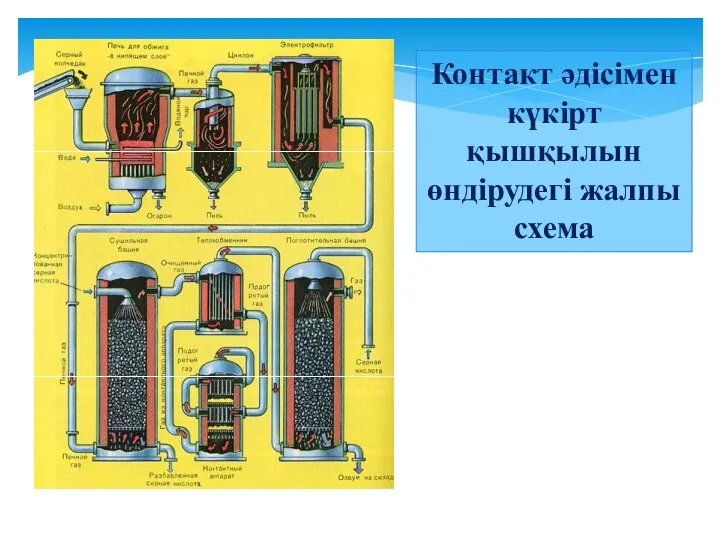
- 16. Контакт әдісімен күкірт қышқылын өндіру әдісі
- 17. Күкірт қышқылын өндіруге қажетті шикізаттар: 1. Бос күкірт S 2. Пирит (күкірт колчеданы) FeS2 3.Күкіртсутек H2S
- 18. Контакт әдісімен күкірт қышқылын өндірудегі жалпы схема
- 19. Бірінші саты- пиритті өртеу «қайнау қабатты пеш" Бірінші сатының реакция теңдеуі t = 800°C 4FeS2 +11O2=
- 20. Пеш газын тазарту Пеш газын қатты қоспамен қақтан тазарту әдісі екі сатыдан тұрады: Циклон аппараты (орталықтанған
- 21. Пеш газының кептірілуі Пеш газының кептірілуі кептіргіш мұнарада жүргізіледі. Төменнен жоғары қарай пеш газы көтеріледі, ал
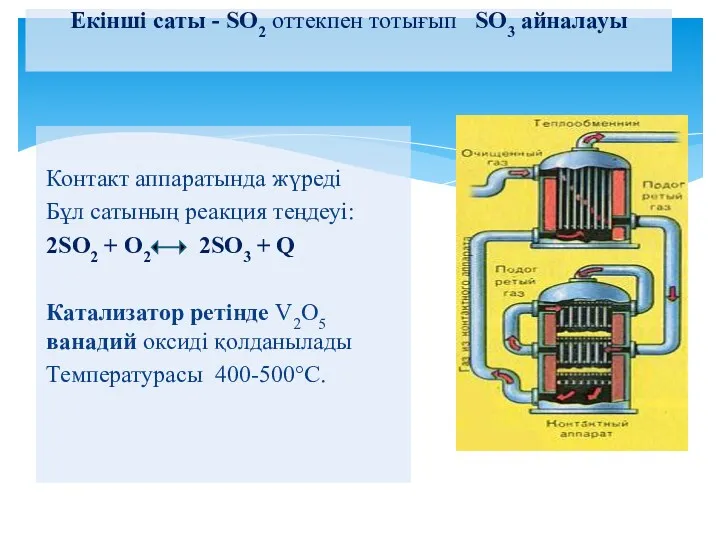
- 22. Екінші саты - SO2 оттекпен тотығып SO3 айналауы Контакт аппаратында жүреді Бұл сатының реакция теңдеуі: 2SO2
- 23. Үшінші саты- SO3 сіңіріп күкірт қышқылын өндіру Сіңіру мұнарасында жүреді Күкірт оксиді қышқылда жақсы еріп олеум
- 25. Скачать презентацию

















 Иондық байланыс
Иондық байланыс Щелочные металлы
Щелочные металлы Камень чароит
Камень чароит Основные особенности композитов по сравнению с традиционными материалами
Основные особенности композитов по сравнению с традиционными материалами Гидроксид железа
Гидроксид железа Методические проблемы преподавания органической химии и ее основные теоретические понятия
Методические проблемы преподавания органической химии и ее основные теоретические понятия Предмет, история и задачи геохимии, положение среди других наук
Предмет, история и задачи геохимии, положение среди других наук Общая характеристика неметаллов
Общая характеристика неметаллов Классификация и номенклатура органических соединений
Классификация и номенклатура органических соединений Фенол қосылыстары
Фенол қосылыстары Алкадиены. Гомологический ряд, номенклатура и изомерия
Алкадиены. Гомологический ряд, номенклатура и изомерия Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Реакции ионного обмена между растворами электролитов
Реакции ионного обмена между растворами электролитов Классификация химических реакций
Классификация химических реакций Этот многоликий цинк
Этот многоликий цинк Аллотропия
Аллотропия Химические свойства толуола
Химические свойства толуола Обмоточные провода
Обмоточные провода Периодические системы химических элементов
Периодические системы химических элементов Барий. Щелочноземельные металлы
Барий. Щелочноземельные металлы Ароматические кислоты фенолокислоты
Ароматические кислоты фенолокислоты Изучение раздела Углеводороды в курсе органической химии в старшей школе
Изучение раздела Углеводороды в курсе органической химии в старшей школе Синтез олиголактозаминов – лигандов галектинов
Синтез олиголактозаминов – лигандов галектинов Білки (протеїни)
Білки (протеїни) Химиялық реакция белгілерін атаңыз
Химиялық реакция белгілерін атаңыз Электрофоретические и хроматографические методы
Электрофоретические и хроматографические методы Основания. 8 класс
Основания. 8 класс Производство серной кислоты контактным способом
Производство серной кислоты контактным способом