Содержание
- 2. Окислительно-восстановительные Реакции обмена По участию катализатора По тепловому эффекту По признаку обратимости КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ:
- 3. Химические реакции –это процессы, в результате которых из одних веществ образуются другие. При химических реакциях происходит
- 4. Реакции, идущие без изменения состава веществ например: С (графит) С (алмаз) 3О2 (кислород) 2О3 (озон) КЛАССИФИКАЦИЯ
- 5. Окислительно-восстановительные реакции: ОВР– реакции, при которых происходит процесс отдачи или принятия электронов. Процесс отдачи – окисление;
- 6. Окислительно-восстановительные реакции Реакции соединения – это реакции, при которых из двух и более веществ образуется одно
- 7. 2. Реакции разложения – это реакции, при которых из одного сложного вещества образуется несколько новых веществ.
- 8. 3. Реакции замещения – это реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента
- 9. 2. Реакции обмена – это реакции, при которых два сложных вещества обмениваются своими составными частями AgNO3
- 10. 3. По участию катализатора: Катализаторы – это вещества, ускоряющие химические реакции, но само в реакции не
- 11. 4. По тепловому эффекту: Экзотермические реакции: Экзотермические реакции – реакции, протекающие с выделением теплоты. К ним
- 12. Эндотермические реакции: Эндотермические реакции – реакции, протекающие с поглощением теплоты. К ним относятся почти все реакции
- 13. 5. По направлению: Необратимые реакции протекают только в одном направлении. К ним относят: реакции идущие с
- 14. Обратимые реакции протекают одновременно в двух противоположных направлениях. Например: N2 + 3H2 2NH3 По направлению:
- 15. Гидрирование – реакция, протекающая с присоединением водорода Гидратация - реакция, протекающая с присоединением воды. Этерификация -
- 17. Скачать презентацию














 Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії
Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії Металл цирконий (ZR)
Металл цирконий (ZR) Отчет по прохождению учебной практики. ПАО Акрон
Отчет по прохождению учебной практики. ПАО Акрон Предельные углеводороды. (9 класс)
Предельные углеводороды. (9 класс) Важнейшие минералы
Важнейшие минералы Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Химический состав клетки. Неорганические вещества клетки. 10 класс
Химический состав клетки. Неорганические вещества клетки. 10 класс Строение атома и химическая связь
Строение атома и химическая связь Поверхностные явления. Адсорбция. Изотерма Ленгмюра
Поверхностные явления. Адсорбция. Изотерма Ленгмюра Коллоидная химия
Коллоидная химия Группа веществ, изолируемых полярными растворителями
Группа веществ, изолируемых полярными растворителями Строение и свойства материалов
Строение и свойства материалов Генетическая связь между классами веществ
Генетическая связь между классами веществ Карбоновые кислоты. (Лекция 6.3)
Карбоновые кислоты. (Лекция 6.3) Дисперсные системы
Дисперсные системы Индикаторы. Круговорот воды в природе. Загрязнение природных вод. Охрана и очистка природных вод
Индикаторы. Круговорот воды в природе. Загрязнение природных вод. Охрана и очистка природных вод Неметаллические материалы
Неметаллические материалы Щавелевая кислота
Щавелевая кислота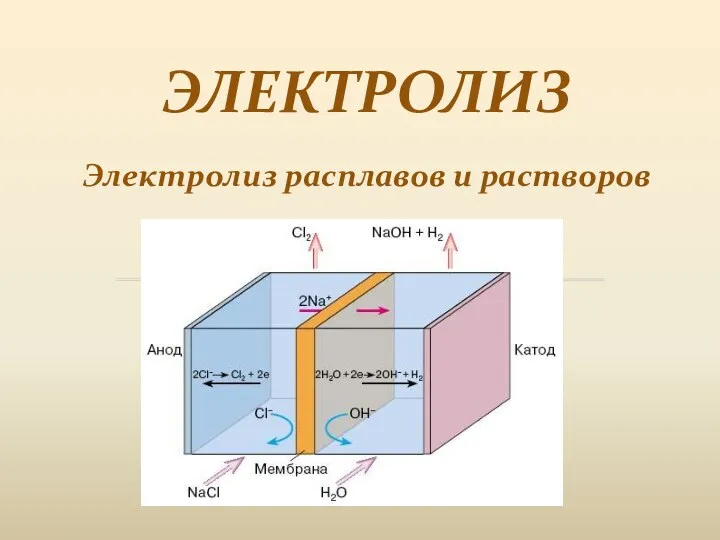 Электролиз. Электролиз расплавов и растворов
Электролиз. Электролиз расплавов и растворов Закономерности изменения свойств элементов в периодах и группах. Химия. 8 класс
Закономерности изменения свойств элементов в периодах и группах. Химия. 8 класс Carbohydrate metabolism
Carbohydrate metabolism Дисперсные системы: общая характеристика и классификация
Дисперсные системы: общая характеристика и классификация Введение. Методы и средства обучения химии
Введение. Методы и средства обучения химии Проект на тему Екзо- та ендотермічні реакції на службі людства
Проект на тему Екзо- та ендотермічні реакції на службі людства Нефть и способы её переработки
Нефть и способы её переработки Окислительные свойства азотной кислоты
Окислительные свойства азотной кислоты Физико-химия дисперсных систем
Физико-химия дисперсных систем Лекция 3. Протолитические равновесия и процессы
Лекция 3. Протолитические равновесия и процессы