Содержание
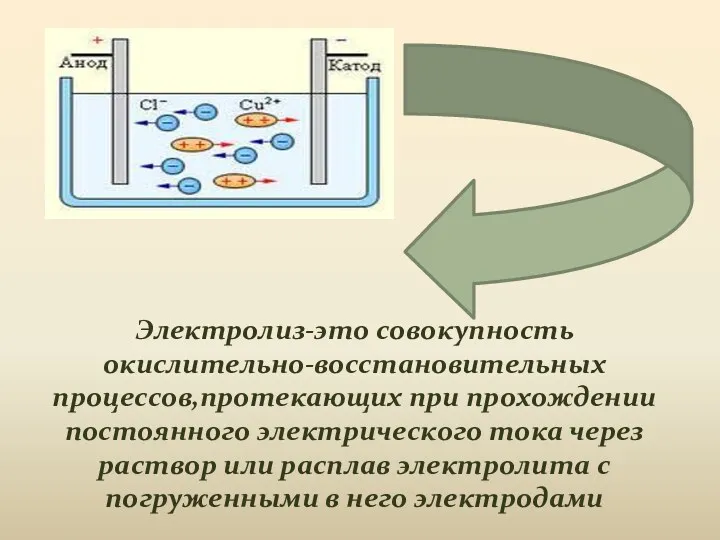
- 2. Электролиз-это совокупность окислительно-восстановительных процессов,протекающих при прохождении постоянного электрического тока через раствор или расплав электролита с погруженными
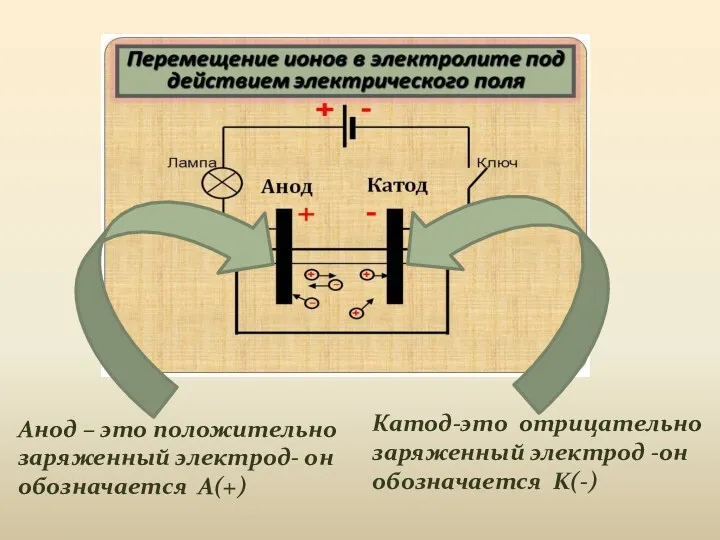
- 3. Катод-это отрицательно заряженный электрод -он обозначается K(-) Анод – это положительно заряженный электрод- он обозначается A(+)
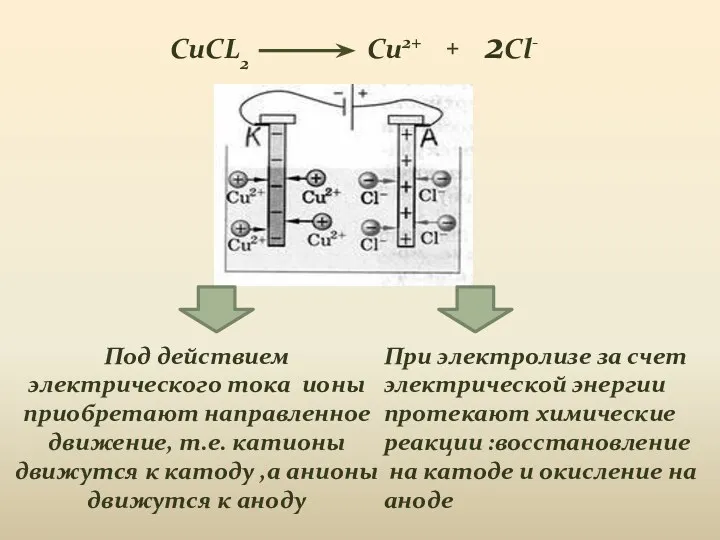
- 4. Под действием электрического тока ионы приобретают направленное движение, т.е. катионы движутся к катоду ,а анионы движутся
- 5. Английский физик и химик, один из основателей электрохимии В конце 18 века он приобрел репутацию хорошего
- 6. Первые его работы в области электрохимии были посвящены изучению действия электрического тока на химические соединения. Он
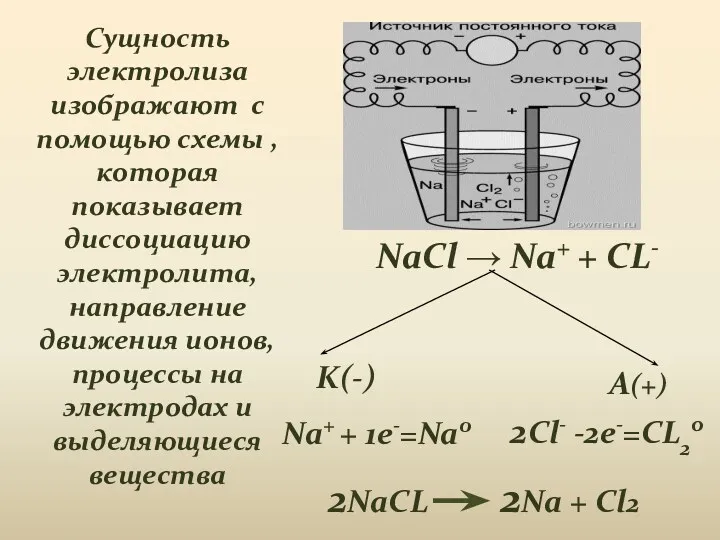
- 7. Сущность электролиза изображают с помощью схемы , которая показывает диссоциацию электролита, направление движения ионов, процессы на
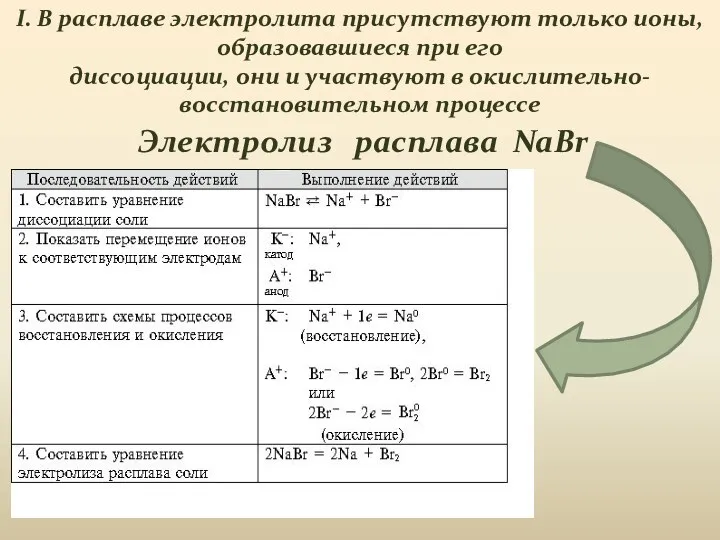
- 8. Электролиз расплава NaBr I. В расплаве электролита присутствуют только ионы, образовавшиеся при его диссоциации, они и
- 9. Электролиз расплава NaOH
- 10. II. Электролиз водного раствора электролита В отличии от расплава в растворе электролита кроме ионов, получившихся при
- 11. MnZnCrFeCoNiSnPb Если у катода накапливаются катионы металла (стоящего в ряду напряжений после H2), то восстанавливаются ионы
- 12. 3) Если у катода накапливаются катионы металла,который расположен в ряду напряжений (после AL и до H2),то
- 13. Последовательность разрядки анионов на аноде зависит от природы аниона: 1) При электролизе растворов солей бескислородных кислот(
- 14. 3) При электролизе растворов щелочей окисляются гидроксид-ионы 4OH- -4e-=O2 +2H2O 2) При электролизе растворов солей кислородосодержащих
- 15. А знаете ли вы, что….. Современную жизнь без электролиза представить себе уже невозможно….
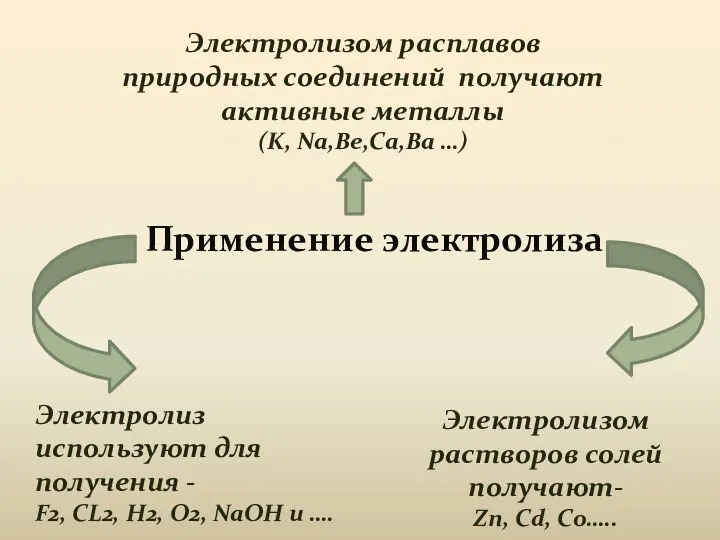
- 16. Применение электролиза Электролизом расплавов природных соединений получают активные металлы (K, Na,Be,Ca,Ba …) Электролизом растворов солей получают-
- 18. Скачать презентацию









 Химические формулы. Относительная молекулярная масса
Химические формулы. Относительная молекулярная масса Источники примесей в натрии быстрых реакторов. Поведение примесей в натрии. Массоперенос продуктов коррозии в натриевых контурах
Источники примесей в натрии быстрых реакторов. Поведение примесей в натрии. Массоперенос продуктов коррозии в натриевых контурах Рідкі кристали
Рідкі кристали 20230205_okislitelno-vosstanovitelnye_reaktsii
20230205_okislitelno-vosstanovitelnye_reaktsii Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості
Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості 20230306_oksidy
20230306_oksidy Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Аммиак. Физические и химические свойства аммиака
Аммиак. Физические и химические свойства аммиака Зависят ли свойства предельных одноатомных спиртов от их химического строения?
Зависят ли свойства предельных одноатомных спиртов от их химического строения? Непредельные углеводороды этиленового ряда (олефины, алкены)
Непредельные углеводороды этиленового ряда (олефины, алкены) Дисперсные системы: получение и свойства
Дисперсные системы: получение и свойства Растворы. Концентрация растворов
Растворы. Концентрация растворов Соли как производные кислот и оснований
Соли как производные кислот и оснований Водород. Свойства водорода
Водород. Свойства водорода Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) Аммиак
Аммиак Суды тазарту әдістері
Суды тазарту әдістері Основания
Основания Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Одноосновные ненасыщенные кислоты
Одноосновные ненасыщенные кислоты Периодическая таблица химических элементов
Периодическая таблица химических элементов Оксиды. Определение
Оксиды. Определение Производство чугуна и стали
Производство чугуна и стали Азот. Характеристика азота, фосфора (9класс)
Азот. Характеристика азота, фосфора (9класс) Тепловой эффект химической реакции
Тепловой эффект химической реакции Значення хімічних процесів у природі
Значення хімічних процесів у природі Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Механохимиялық активтеу әдісі
Механохимиялық активтеу әдісі