Содержание
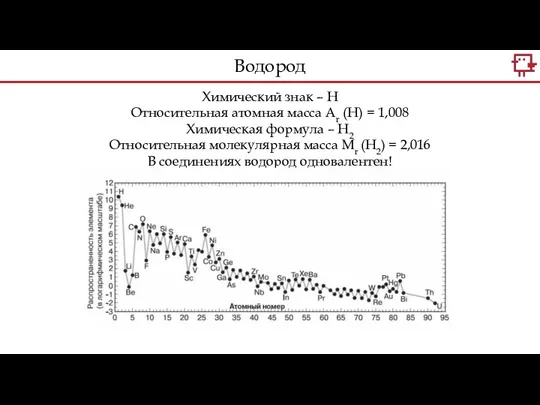
- 2. Химический знак – Н Относительная атомная масса Аr (Н) = 1,008 Химическая формула – Н2 Относительная
- 3. Получение водорода: 2H2O (ж) = 2H2(г) + O2(г) – 484 кДж В лабораторных условиях водород проще
- 4. Водород – бесцветный самый легкий газ. Растворимость водорода в воде крайне мала. Температура сжижения -252,8С Водород
- 5. Водород соединяется с кислородом… Гремучей газ – смесь двух объёмов водорода и одного объёма кислорода. Водород
- 6. Водород взаимодействует с оксидами некоторых металлов: H2 + CuO = H2O + Cu При обычной температуре:
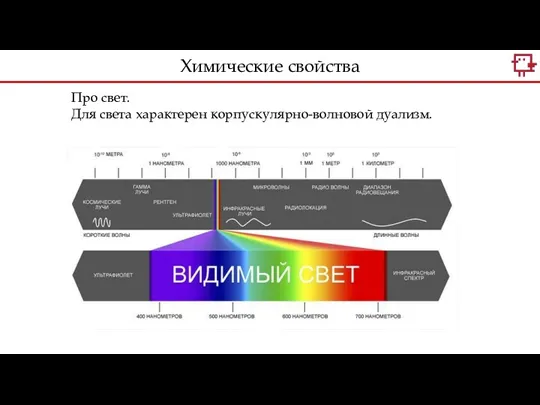
- 7. Про свет. Для света характерен корпускулярно-волновой дуализм. Химические свойства
- 8. Про свет. Для света характерен корпускулярно-волновой дуализм. Химические свойства
- 9. На свету: H2 + Cl2 = 2HCl(г) + 185 кДж Посмотрим схему реакции: Cl2 + hν
- 10. При реакции с простыми веществами образуются гидриды: 2Li + H2 = 2LiH (гидрид лития) Гидриды взаимодействуя
- 11. Получение водорода. В промышленности. Электролиз водных растворов солей. 2H2O = H2 + O2 Пропускание паров воды
- 13. Скачать презентацию








 Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Классификация и свойства оксидов
Классификация и свойства оксидов Цветные сплавы
Цветные сплавы Водородная связь
Водородная связь Тяжелые металлы. Загрязнение токсичными металлами окружающей среды
Тяжелые металлы. Загрязнение токсичными металлами окружающей среды Виды вспомогательного оборудования химических производств
Виды вспомогательного оборудования химических производств Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Биологически важные 5-ти и 6-ти членные гетероциклические соединения. (Лекция 25)
Биологически важные 5-ти и 6-ти членные гетероциклические соединения. (Лекция 25) Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3
Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3 Комплексономертиялық титрлеу. Дәріс № 6
Комплексономертиялық титрлеу. Дәріс № 6 Предельные углеводороды
Предельные углеводороды Физико-химические методы анализа. Лекция 1
Физико-химические методы анализа. Лекция 1 Теплові явища, що супроводжують розчинення речовин. Розчинення як фізико-хімічний процес. Кристалогідрати
Теплові явища, що супроводжують розчинення речовин. Розчинення як фізико-хімічний процес. Кристалогідрати Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители
Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители Роль хімії в пізнанні природи
Роль хімії в пізнанні природи Строение атома и химическая связь
Строение атома и химическая связь Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Алкадиены. Химические свойства алкадиенов
Алкадиены. Химические свойства алкадиенов Азотсодержащие органические соединения. Амины. Анилинароматический амин
Азотсодержащие органические соединения. Амины. Анилинароматический амин Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Гидрогеохимия урана и тория
Гидрогеохимия урана и тория Общая характеристика элементов IБгруппы. Медь. Серебро. Золото
Общая характеристика элементов IБгруппы. Медь. Серебро. Золото D-элементы: хром, молибден, вольфрам
D-элементы: хром, молибден, вольфрам Alkynes
Alkynes Строение алканов. Физические и химические свойства алканов. Получение алканов
Строение алканов. Физические и химические свойства алканов. Получение алканов Карбоновые кислоты
Карбоновые кислоты Синтетические органические вещества
Синтетические органические вещества Окисление перманганатом и бихроматом калияорганических соединений. Уровень ЕГЭ
Окисление перманганатом и бихроматом калияорганических соединений. Уровень ЕГЭ