Содержание
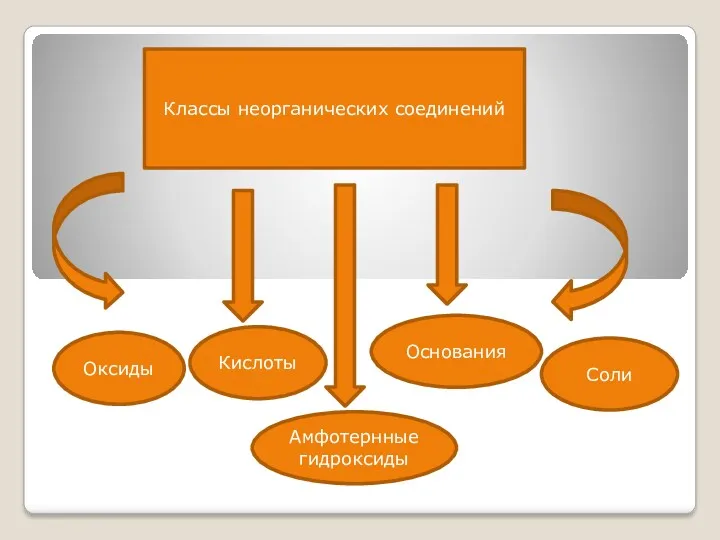
- 2. Классы неорганических соединений Оксиды Кислоты Основания Соли Амфотернные гидроксиды
- 3. оксиды Из слов составьте определение оксидов: состоящие, бинарные,из, соединения, элементов двух, кислород, одним, со, которых, степенью,
- 4. Правильный ответ Оксиды-бинарные соединения, состоящие из двух элементов, одним из которых является кислород со степенью окисления
- 5. Оксиды в природе
- 6. Оксиды в природе
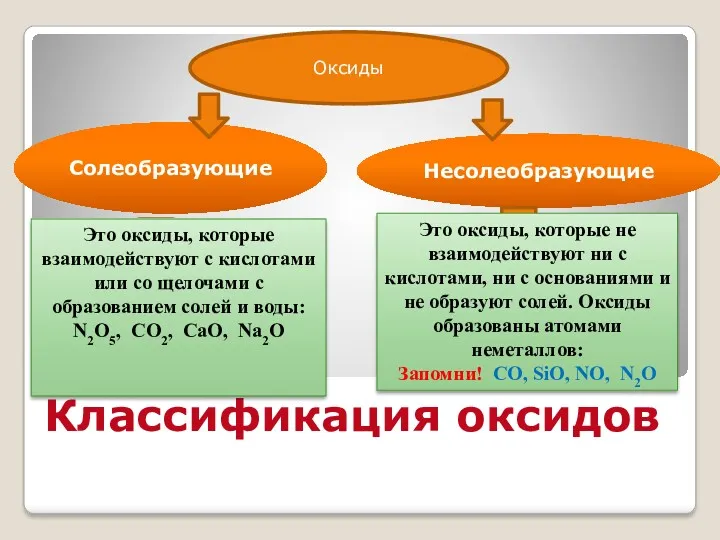
- 7. Классификация оксидов Солеобразующие Несолеобразующие Это оксиды, которые не взаимодействуют ни с кислотами, ни с основаниями и
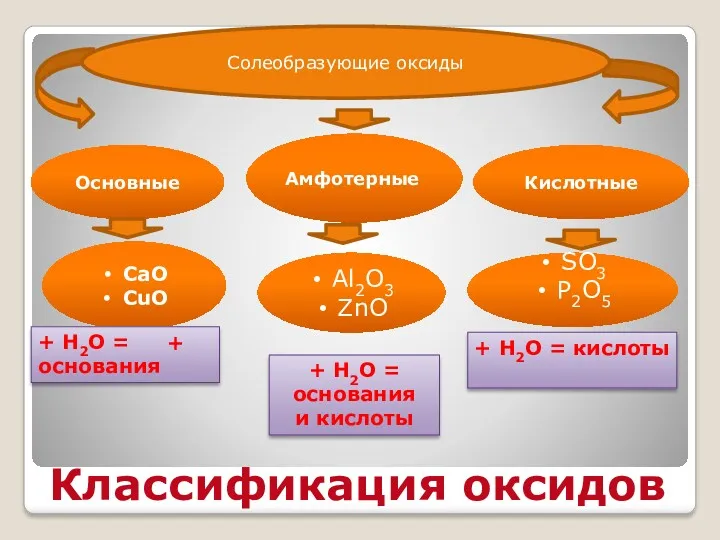
- 8. Классификация оксидов Основные Амфотерные Кислотные CaO CuO Al2O3 ZnO SO3 P2O5 + Н2О = основания +
- 9. Проанализируйте состав основных оксидов и дайте полные определения основным, оксидам. Вставьте нужные термины Основные:MnO, Li2O, NiO,
- 10. Проанализируйте состав кислотных оксидов и дайте полные определения кислотным оксидам Кислотные Cl2O,Cl2O7,MnO3,Mn2O7, N2O5, SO2, это оксиды-
- 11. Амфотерные MnO2, Al2O3, Fe2O3, Cr2O3 исключение ZnO, BeO, PbO,SnO Проанализируйте состав амфотерных оксидов и дайте полные
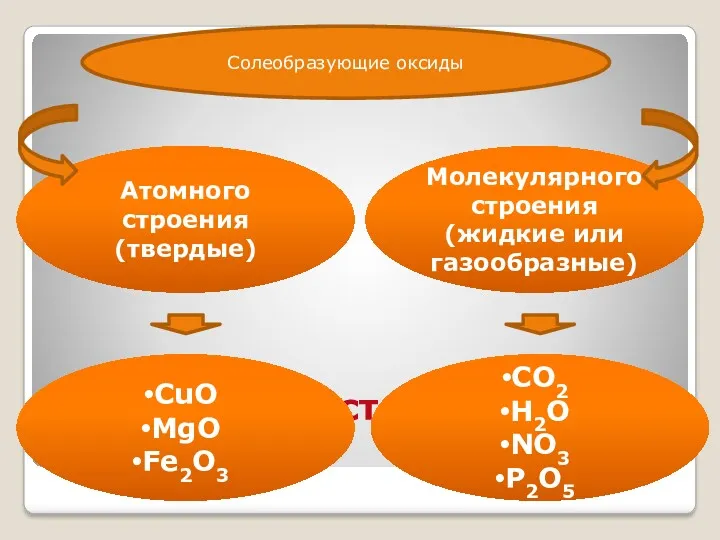
- 12. Агрегатное состояние оксидов: Атомного строения (твердые) Молекулярного строения (жидкие или газообразные) CuO MgO Fe2O3 CO2 H2O
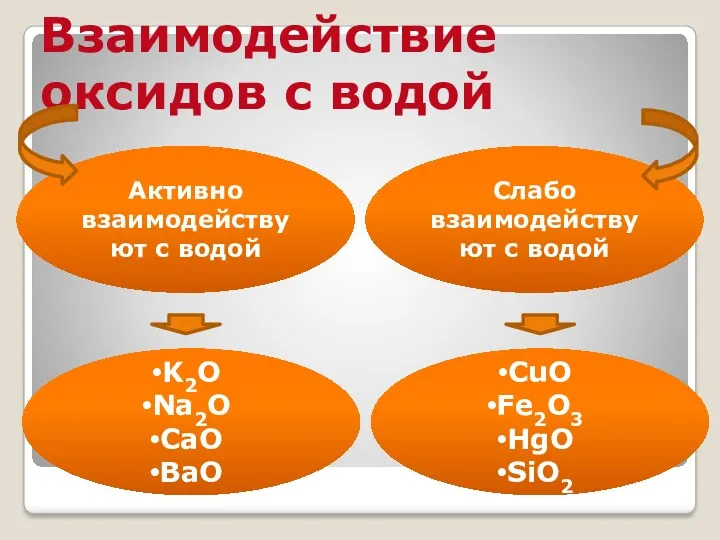
- 14. Взаимодействие оксидов с водой Активно взаимодействуют с водой Слабо взаимодействуют с водой K2O Na2O CaO BaO
- 15. Химические свойства основных оксидов 1. Восемь основных оксидов (оксиды щелочных и шелочно-земельных металлов) взаимодействуют с водой
- 16. Химические свойства основных оксидов 2. Все основные оксиды взаимодействуют с сильными кислотами с образованием соли и
- 17. Химические свойства основных оксидов 3. Взаимодействие основных и кислотных оксидов между собой с образованием соли: CaO
- 18. Химические свойства кислотных оксидов 1. Практически все кислотные оксиды, кроме оксида кремния(IV) взаимодействуют с водой с
- 19. Химические свойства кислотных оксидов 2. Взаимодействие кислотных оксидов со щелочами с образованием соли и воды: ?NaOH+SO2=Na2SO3+
- 20. Химические свойства кислотных оксидов 3. Взаимодействие кислотных оксидов с основными оксидами с образованием соли: SiO2 +
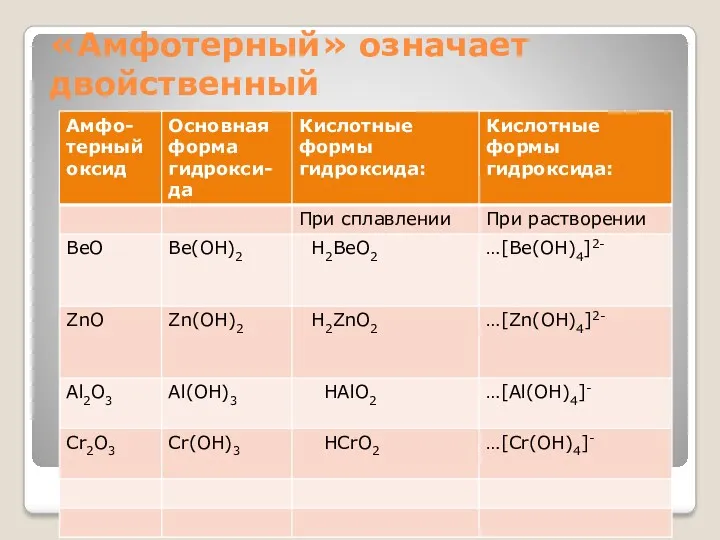
- 21. «Амфотерный» означает двойственный
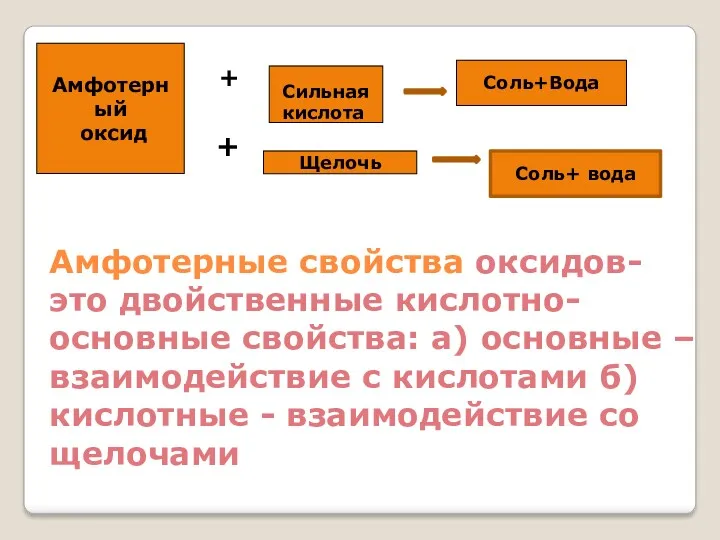
- 22. Амфотерный оксид Соль+Вода + Амфотерные свойства оксидов- это двойственные кислотно-основные свойства: а) основные – взаимодействие с
- 23. Химические свойства амфотерных оксидов Основные свойства ZnO + H2SO4 = ZnSO4 + H2O Кислотные свойства При
- 25. Скачать презентацию















 Металлы, их свойства и область применения
Металлы, их свойства и область применения Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Тяжелые металлы
Тяжелые металлы Гидрокси(окси) кислоты
Гидрокси(окси) кислоты Значение пищи и ее состав
Значение пищи и ее состав Коррозия металлов
Коррозия металлов Изучение процесса коррозии железа (домашний эксперимент)
Изучение процесса коррозии железа (домашний эксперимент) Борьба с биологической коррозией
Борьба с биологической коррозией Реакции ионного обмена
Реакции ионного обмена Спирты
Спирты Газовые смеси
Газовые смеси Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Титриметрический анализ. Кривые титрования
Титриметрический анализ. Кривые титрования Адсорбция
Адсорбция Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Химические реакции или химические явления
Химические реакции или химические явления Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение
Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение Хром, марганец
Хром, марганец Химическая кинетика и катализ
Химическая кинетика и катализ Свойства фосфора
Свойства фосфора Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) Тұндыру әдістері
Тұндыру әдістері Термодинамика химических процессов
Термодинамика химических процессов Чистые вещества и смеси. Химия. 8 кл
Чистые вещества и смеси. Химия. 8 кл Обед под микроскопом. Минеральные вещества
Обед под микроскопом. Минеральные вещества Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН