Содержание
- 2. Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами.
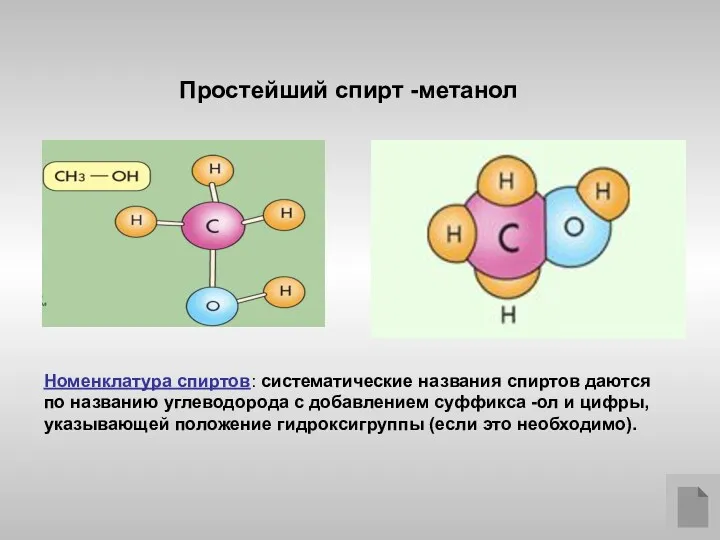
- 3. Простейший спирт -метанол Номенклатура спиртов: систематические названия спиртов даются по названию углеводорода с добавлением суффикса -ол
- 4. Классификация спиртов 1. По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа -ОН) и многоатомные
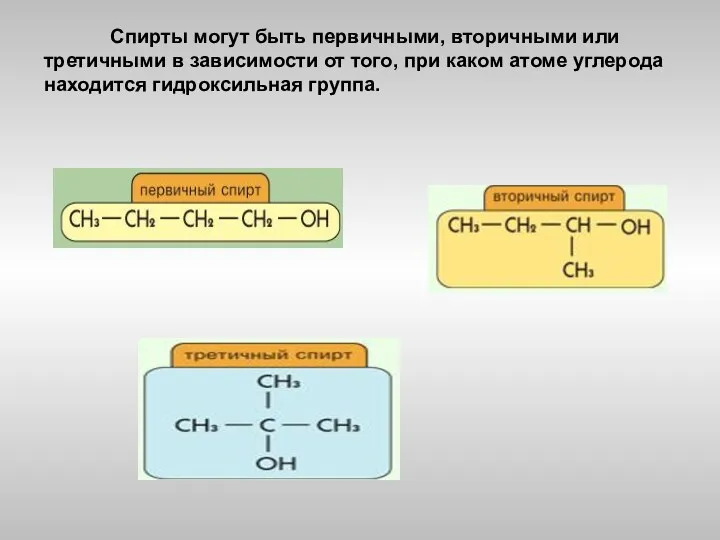
- 5. Спирты могут быть первичными, вторичными или третичными в зависимости от того, при каком атоме углерода находится
- 6. Изомерия изомерия положения ОН - группы, (начиная с С3) ; углеродного скелета, (начиная с С4 );
- 7. Физические свойства Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность
- 8. Одноатомные спирты Многоатомные спирты
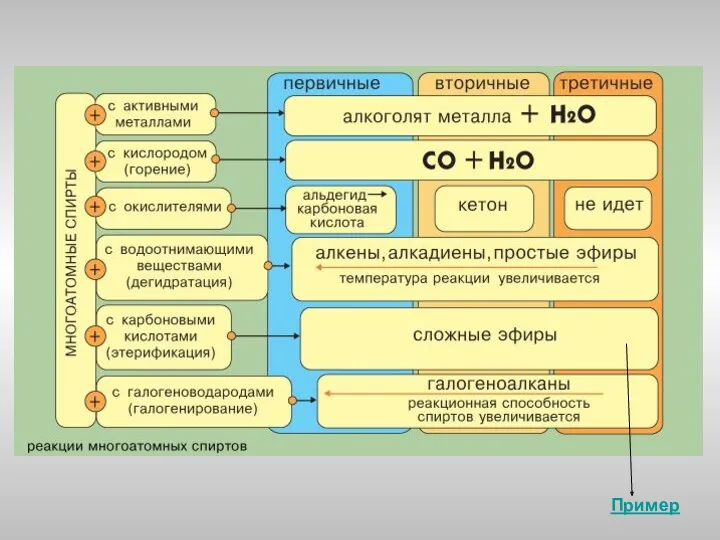
- 9. Реакции замещения водорода функциональной группы Реакции замещения функциональной группы Реакции элиминирования Реакции окисления Реакции этерификации Химические
- 10. Реакции замещения Одноатомные спирты реагируют с активными металлами (Na, K, Mg, Al и др), образуя соли
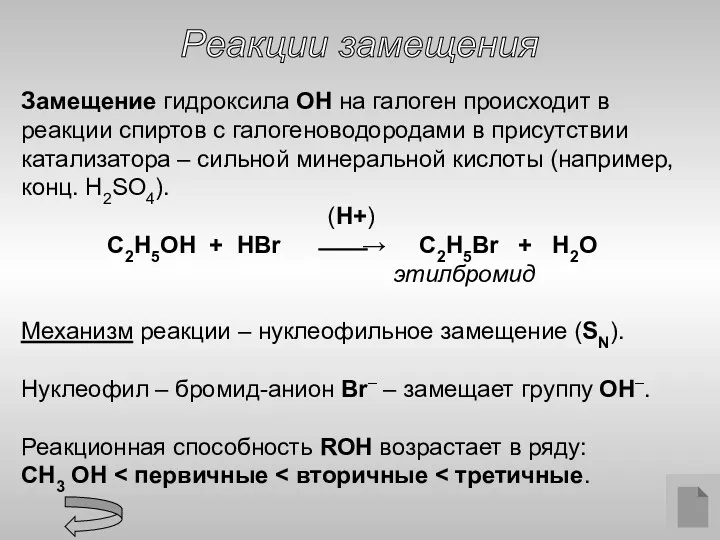
- 11. Реакции замещения Замещение гидроксила ОН на галоген происходит в реакции спиртов с галогеноводородами в присутствии катализатора
- 12. Реакции дегидратации Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при нагревании
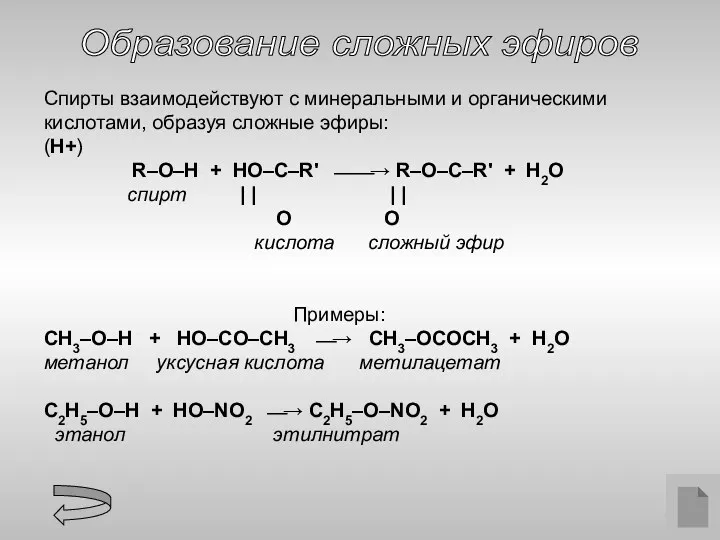
- 13. Образование сложных эфиров Спирты взаимодействуют с минеральными и органическими кислотами, образуя сложные эфиры: (H+) R–O–H +
- 14. Реакции окисления При действии окислителей (KMnO4, K2Cr2O7+H2SO4, O2+катализатор) группа >СH–О–Н превращается в карбонильную группу >С=О, а
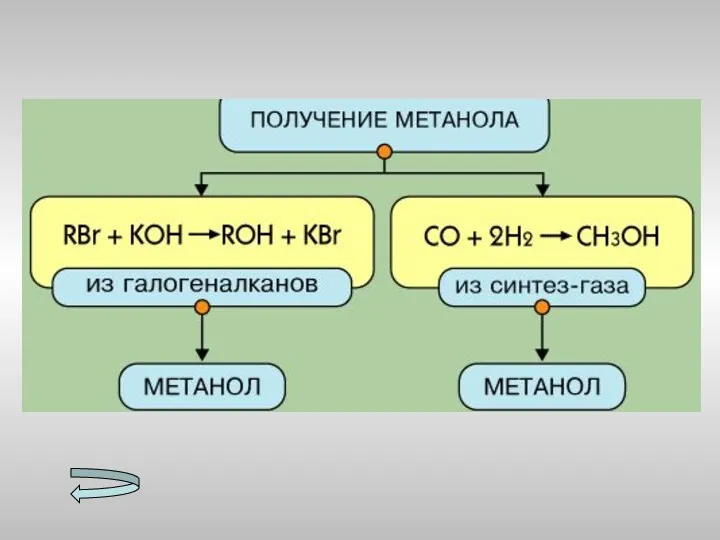
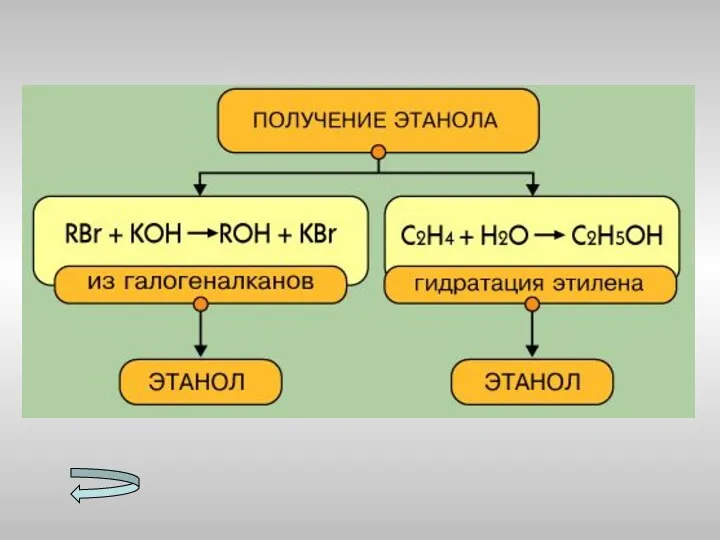
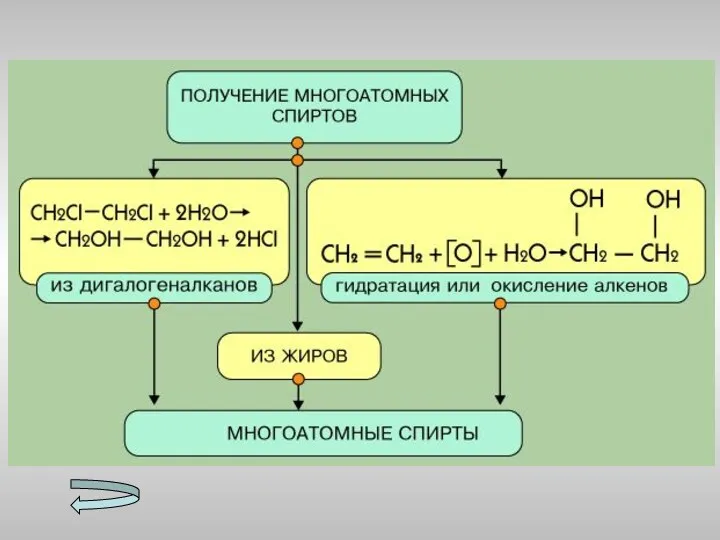
- 15. Получение спиртов Метанола Этанола Многоатомных спиртов
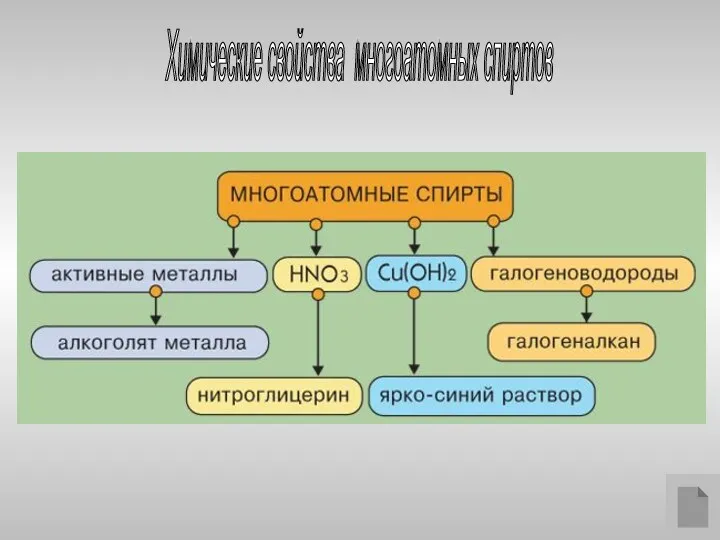
- 19. Химические свойства многоатомных спиртов
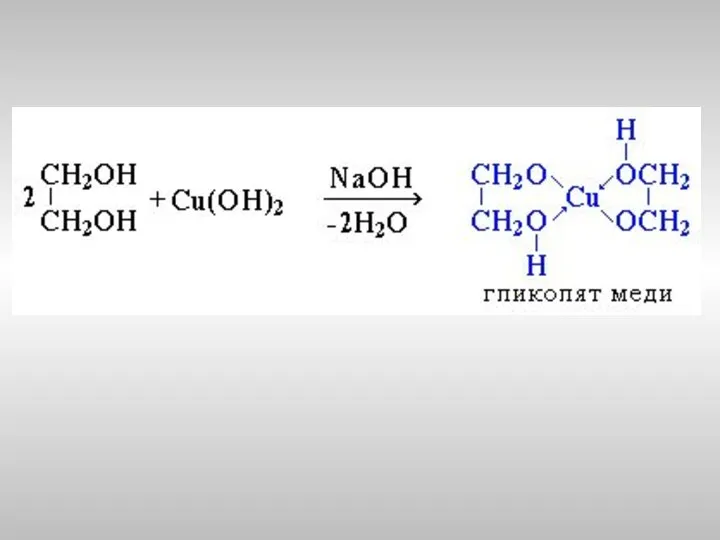
- 20. Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов
- 22. Пример
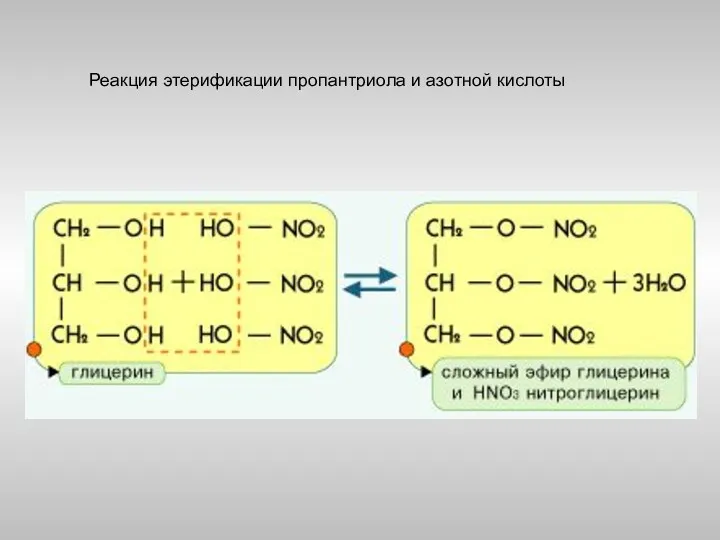
- 23. Реакция этерификации пропантриола и азотной кислоты
- 24. Применение спиртов Метанол CH3OH -производство формальдегида, муравьиной кислоты; - растворитель. Этанол С2Н5ОН (этиловый спирт) - производство
- 25. Применение спиртов Этиленгликоль HOCH2-CH2OH - производство пластмасс; - компонент антифризов; - сырье в органическом синтезе. Глицерин
- 27. Скачать презентацию













 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Соединения щелочных металлов
Соединения щелочных металлов Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою Алканы
Алканы Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Предельные углеводороды
Предельные углеводороды Комплесные соединения
Комплесные соединения Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты
Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Алюминий и его соединения
Алюминий и его соединения Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Азотистые гетероциклические соединения
Азотистые гетероциклические соединения Формы минералов и их агрегатов
Формы минералов и их агрегатов Химические свойства металлов
Химические свойства металлов Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі Угарный газ
Угарный газ Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Ферум та його сполуки
Ферум та його сполуки Аминокислоты. Белки
Аминокислоты. Белки