Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ презентация
Содержание
- 3. Степени окисления атомов и формулы веществ Степень окисления атома – условный заряд атома, вычисленный из предположения,
- 4. H0─H0 H+→Cl- H+→ O-2←H+ H+→ O-1─ O-1 ← H+ N0 ≡ N0 H+ F-1 ↓ ↑
- 5. Упражнения: Чему равна степень окисления атома, если: А) две связи с более ЭО атомами и одна
- 6. Определение степени окисления В соединении А у атомов кислорода такая же степень окисления, как у кальция
- 7. Окислительно-восстановительные реакции
- 8. С +4 +2 0 -4 восстановитель Окисленная форма 3C+2O + Fe2+3O3 = 3C+4O2 +2Fe0 окислитель Fe
- 9. Закончи уравнения полуреакций окисления и восстановления (с учетом числа атомов, где необходимо), укажи окислителем (О) или
- 10. определение степеней окисления элементов, записывание под формулами основных участников ОВР (веществ, в составе которых имеются элементы,
- 11. -2 +6 -1 +3 C+2O + Fe2+3O3 = C+4O2 + Fe0 3 3 2 -2 +3
- 12. В одном веществе атомы одного элемента с разной степенью окисления – все восстановители Na2S2O3 -2 -6
- 13. Метод кислородного баланса C4H8 + KMnO4 + H2SO4 → C3H6O2 + СO2+MnSO4 + K2SO4 +H2O C4H8
- 15. Скачать презентацию
 Аммиак. Физические и химические свойства аммиака
Аммиак. Физические и химические свойства аммиака Кристаллы и минералы
Кристаллы и минералы Углерод. Аллотропные состояния углерода
Углерод. Аллотропные состояния углерода Углеводы: классификация, строение и физико-химические свойства
Углеводы: классификация, строение и физико-химические свойства Полифенолды қосылыстар. Флавоноидтар
Полифенолды қосылыстар. Флавоноидтар Соединения серы
Соединения серы Экзаменационные вопросы. Химическая связь в твердых телах
Экзаменационные вопросы. Химическая связь в твердых телах Гидросульфит натрия (пищевая добавка Е222)
Гидросульфит натрия (пищевая добавка Е222) Кислородные соединения азота
Кислородные соединения азота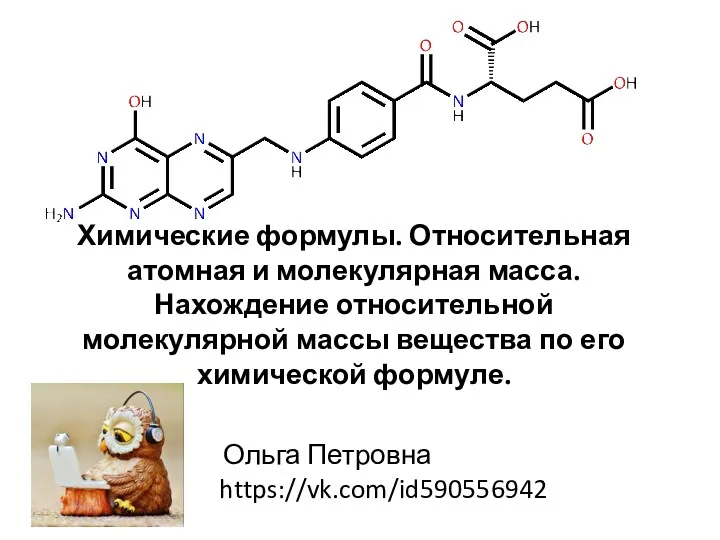 Химические формулы. Относительная атомная и молекулярная масса
Химические формулы. Относительная атомная и молекулярная масса Общие проблемы определения низких концентраций
Общие проблемы определения низких концентраций Природные (натуральные) полимеры. Композиционные материалы
Природные (натуральные) полимеры. Композиционные материалы Предельные углеводороды
Предельные углеводороды Никель қаптамаларын алу жолдары
Никель қаптамаларын алу жолдары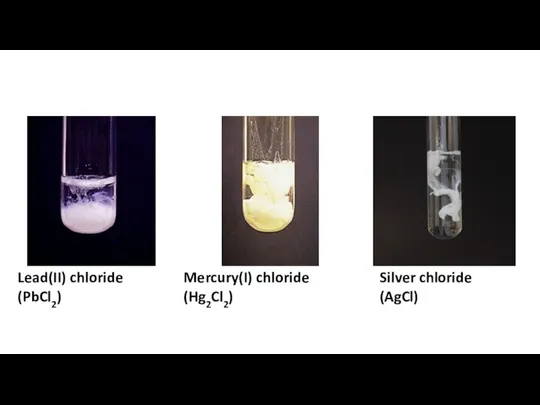 Separation amp confirmation
Separation amp confirmation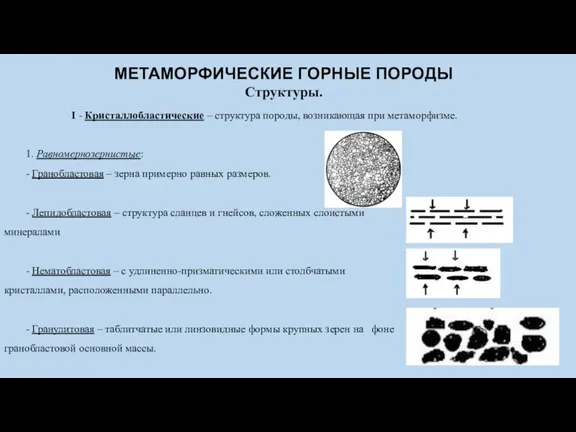 Метаморфические горные породы
Метаморфические горные породы Углерод и его свойства
Углерод и его свойства Аминокислоты. Физические свойства
Аминокислоты. Физические свойства Романенко
Романенко Каталитикалық риформинг
Каталитикалық риформинг Амінокислоти
Амінокислоти Nitraty
Nitraty Способы выражения состава раствора
Способы выражения состава раствора Атомы химических элементов
Атомы химических элементов Химиялық кинетика және электрохимия
Химиялық кинетика және электрохимия Криминалистическое исследование нефтепродуктов, горючесмазочных материалов, спиртосодержащих жидкостей,
Криминалистическое исследование нефтепродуктов, горючесмазочных материалов, спиртосодержащих жидкостей, Обмен сложных липидов
Обмен сложных липидов Поверхностные явления
Поверхностные явления