Слайд 2

Строение молекулы
Молекула аммиака имеет форму правильного тетраэдра (чай «Липтон» в пирамидках)
с атомом азота в вершине. Три неспаренных электрона азота соединяются с атомами водорода, образуя ковалентную связь по обменному механизму.
Неподелённая электронная пара атома азота образует ковалентную связь по донорно-акцепторному механизму с ионом водорода, в результате образуется ион аммония NH4+.
Слайд 3

Физические свойства
Аммиак при нормальных условиях — бесцветный газ с резким характерным
запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит.
Пары аммиака вызывают обильное слезотечение, химический ожог роговицы глаза и, как следствие, потерю зрения, приступы кашля, покраснение и зуд кожи.
Сжижается при температуре -35°С.
Молекула аммиака обладает высокой полярностью, что приводит к хорошей растворимости аммиака в воде (в 1л воды при комнатной температуре растворяется 700л аммиака!). Поэтому при получении аммиака нельзя использовать воду!
Слайд 4

ХИМИЧЕСКИЕ СВОЙСТВА
Аммиак очень «общительный», взаимодействует со многими веществами.
Восстанавливает металлы из
их оксидов.
При взаимодействии с кислотами образует соли аммония NH4+. Я привела только один пример с азотной кислотой, а вы приведите другие примеры!
При растворении в воде образует нашатырный спирт NH4OH.
При взаимодействии с галогенами образуется молекулярный азот и галогеноводород (способ получения азота).
Аммиак легко сгорает в кислороде, образуя молекулярный азот и воду. Но если эту реакцию проводить в присутствии катализатора – платины, то образуется оксид азота (II) и вода.
Взаимодействие аммиака с пероксидом водорода приводит к образованию молекулярного азота и воды.
Слайд 5

Способы получения
Способов получения аммиака достаточно много, рассмотрим только некоторые из них.
Прямой
синтез из водорода и азота протекает при температуре 400-450°С в присутствии катализатора – железа или платины. В промышленности используется железа, как более дешёвое.
Лабораторный способ получения аммиака – взаимодействие кристаллического хлорида аммония с кристаллическим гидроксидом кальция при нагревании.
Получить аммиак можно при растворении нитридов металлов в воде. Кроме аммиака в этом случае образуется ещё и гидроксид металла. Приведите свой пример!
Слайд 6

КАЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ АММИАКА
То, что в ходе реакции выделяется аммиак, можно определить
двумя способами.
Первый: необходимо поднести к пробирке влажную лакмусовую бумажку. Выделяющийся аммиак будет реагировать с водой на поверхности бумажки, образуя гидроксид аммония. Бумажка посинеет, т.к. почувствует щелочную среду.
Второй: к пробирке надо поднести стеклянную палочку, смоченную концентрированной соляной (азотной, серной) кислотой, появится белый дым – это кристаллы хлорида аммония (нитрат аммония, сульфат аммония).
Слайд 7

Слайд 8

ПРИМЕНЕНИЕ АММИАКА
Важнейшее применение аммиака – это сырьё для производства азотной кислоты.
Непосредственно из аммиака получают соли аммония, которые являются минеральными удобрениями (нитрат и сульфат аммония, мочевина), взрывчатые вещества, полимеры и др.
Жидкий аммиак используют в качестве растворителя.
В холодильной технике аммиак используется как хладагент.
В медицине применяется раствор аммиака в воде, который известен как нашатырный спирт. Резкий запах нашатырного спирта помогает привести в чувство находящегося в обмороке человека.
Слайд 9

ТРИВИАЛЬНЫЕ НАЗВАНИЯ
Индийская селитра КNO3
Чилийская селитра NaNO3
Аммиачная вода (нашатырный спирт) – водный
раствор NH3 (NH4OH)
Нашатырь – NH4Cl








 Взрывчатые вещества. Пероксид ацетона и пикриновая кислота
Взрывчатые вещества. Пероксид ацетона и пикриновая кислота Алкадиены. Общая формула алкадиенов CnH2n -2
Алкадиены. Общая формула алкадиенов CnH2n -2 Закономерности изменения химических свойств элементов и их соединений. Лекция 2. Индустрия красоты
Закономерности изменения химических свойств элементов и их соединений. Лекция 2. Индустрия красоты Изотопы. История открытия. Изотопы водорода
Изотопы. История открытия. Изотопы водорода Количество вещества. Лекция №2
Количество вещества. Лекция №2 Функциональные производные карбоновых кислот
Функциональные производные карбоновых кислот Сахароза
Сахароза Полівінілхлорид
Полівінілхлорид Органічні речовини в живій природі. Рівні структурної органшзації
Органічні речовини в живій природі. Рівні структурної органшзації Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Методы защиты металлов от электрохимической коррозии. Классификация методов защиты бетона и железобетона
Методы защиты металлов от электрохимической коррозии. Классификация методов защиты бетона и железобетона Гідроліз солей
Гідроліз солей Прикладная химия. Теплоперенос в химических реакторах и теплообменники
Прикладная химия. Теплоперенос в химических реакторах и теплообменники Обратимые реакции. Химическое равновесие. Смещение равновесия
Обратимые реакции. Химическое равновесие. Смещение равновесия Электролиз
Электролиз Нанотехнологии. Отдельные представители наночастиц
Нанотехнологии. Отдельные представители наночастиц Периодический закон и периодическая система Д.И. Менделеева
Периодический закон и периодическая система Д.И. Менделеева Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Растворы
Растворы Органическая химия. Вещества
Органическая химия. Вещества Соединения химических элементов. Валентность и степень окисления элементов
Соединения химических элементов. Валентность и степень окисления элементов Теория электролитической диссоциации
Теория электролитической диссоциации Класи неорганічних сполук
Класи неорганічних сполук Железо. Соединения железа
Железо. Соединения железа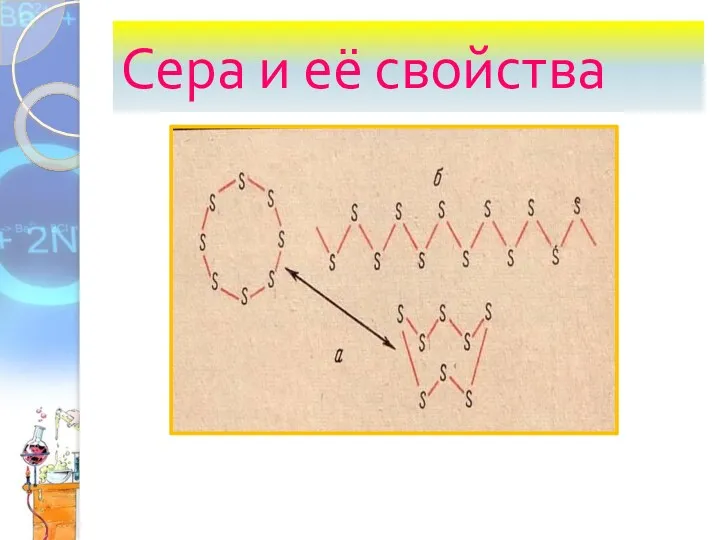 Сера и её свойства
Сера и её свойства Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019
Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019 Свинец (Pb)
Свинец (Pb) Азот: кислородные соединения. Особенности химии фосфора и элементов его подгруппы
Азот: кислородные соединения. Особенности химии фосфора и элементов его подгруппы