Закономерности изменения химических свойств элементов и их соединений. Лекция 2. Индустрия красоты презентация
Содержание
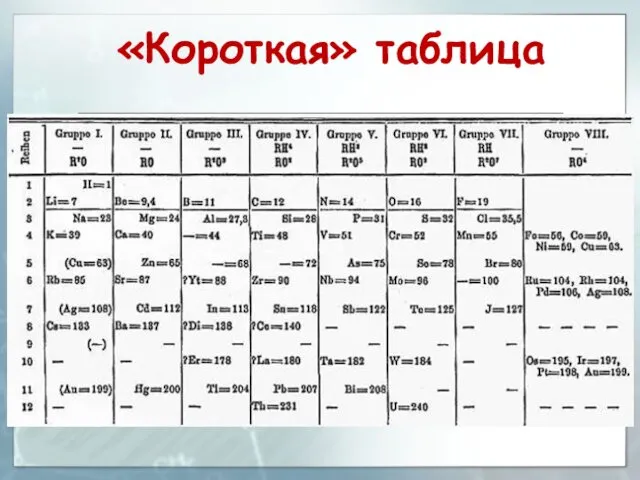
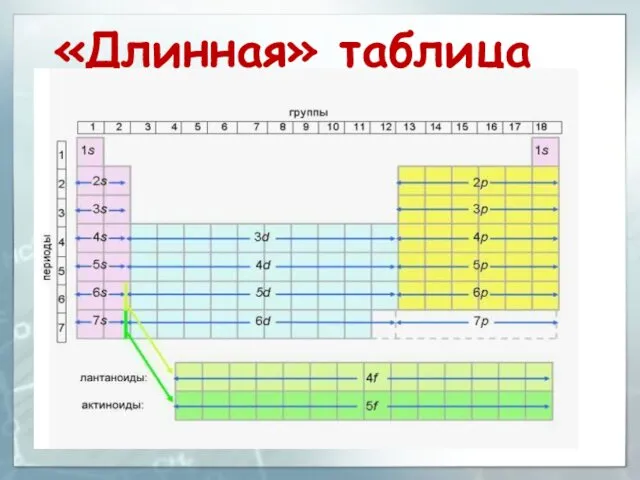
- 3. Структура периодической системы Наиболее распространёнными являются 3 формы таблицы Менделеева. В «сверхдлинном» варианте каждый период занимает
- 4. «Короткая» таблица
- 5. «Длинная» таблица
- 6. Короткая форма таблицы, содержащая восемь групп элементов была официально отменена ИЮПАК в 1989 году.
- 7. Значение периодической системы Благодаря системе сложилось современное понятие о химическом элементе, были уточнены представления о простых
- 8. В ходе исследований атома методами физики было установлено, что порядковый номер элемента в таблице Менделеева (атомный
- 9. Появление периодической системы открыло новую, подлинно научную эру в истории химии и ряде смежных наук —
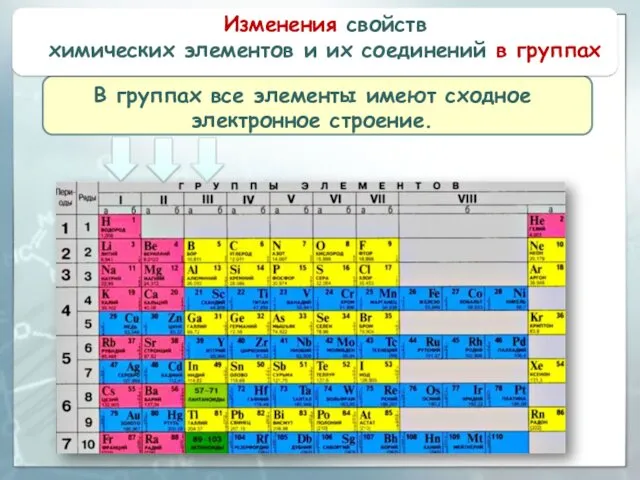
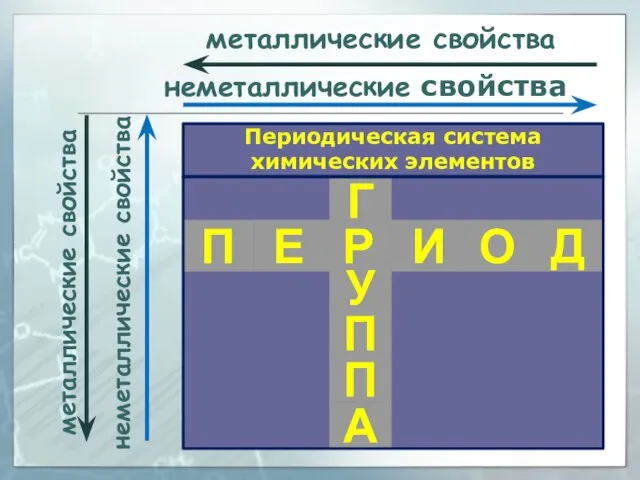
- 10. Изменения свойств химических элементов и их соединений в группах В группах все элементы имеют сходное электронное
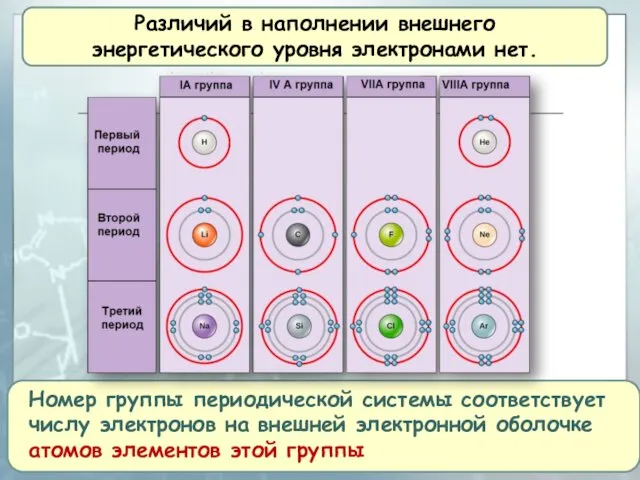
- 11. Различий в наполнении внешнего энергетического уровня электронами нет. Номер группы периодической системы соответствует числу электронов на
- 12. Меняется размер атома - сверху вниз в группе радиусы атомов увеличиваются! Периодический закон Д. И. Менделеева:
- 13. в группе сверху вниз: усиливаются основные свойства их соединений внешние электроны все слабее притягиваются к ядру
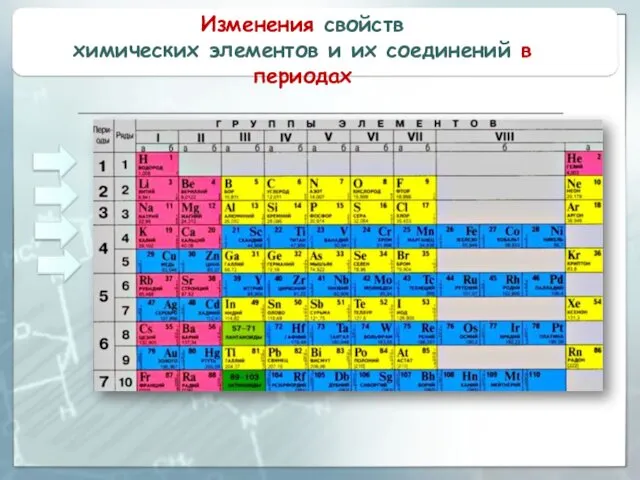
- 14. Изменения свойств химических элементов и их соединений в периодах
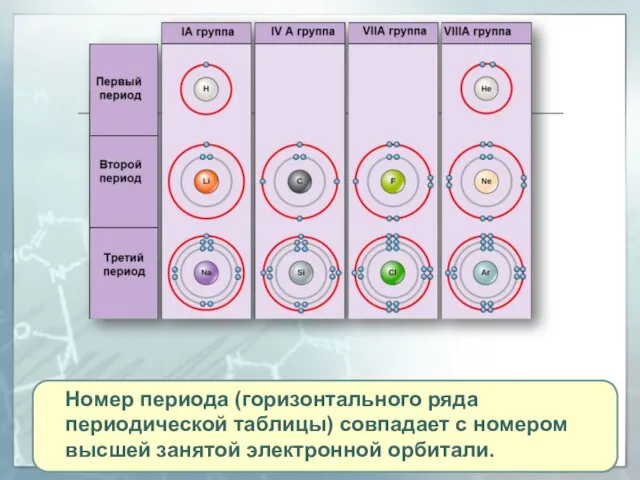
- 15. Номер периода (горизонтального ряда периодической таблицы) совпадает с номером высшей занятой электронной орбитали.
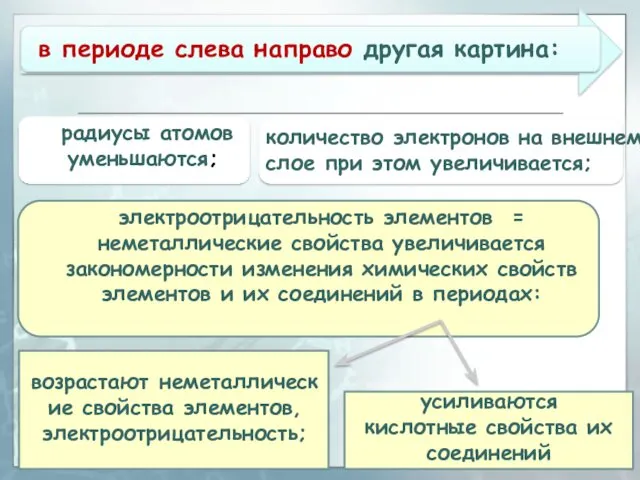
- 16. в периоде слева направо другая картина: усиливаются кислотные свойства их соединений радиусы атомов уменьшаются; количество электронов
- 18. С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических
- 19. Zn Cr Al Sn Pb Mn Fe Be Есть еще элементы, которые образуют так называемые амфотерные
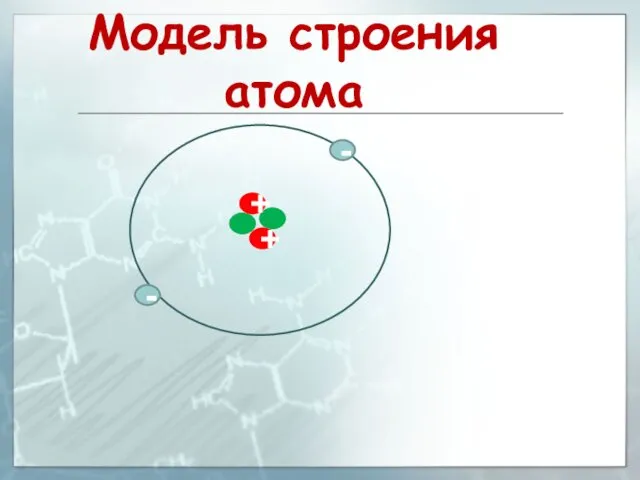
- 20. Атом – электронейтральная система взаимодействующих элементарных частиц, состоящего из ядра (образованного протонами и нейтронами) и электронов.
- 21. - - Модель строения атома
- 22. Изотопы – это разновидности атомов одного и того же хим.элемента, имеющие одинаковое число протонов но разное
- 23. 2H — дейтерий (D)
- 24. 3H — тритий (радиоактивен) (T).
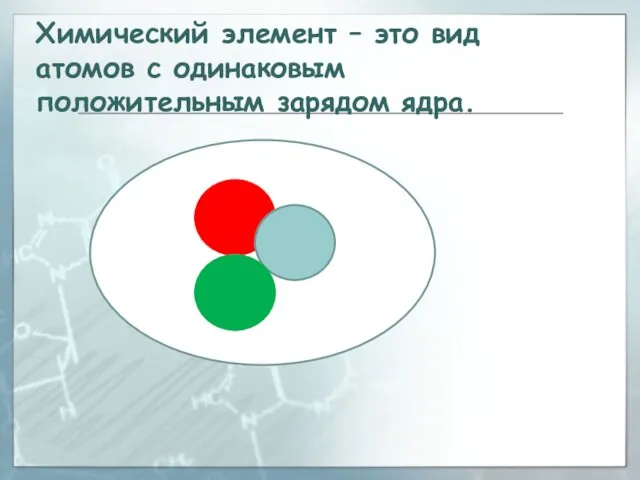
- 25. Химический элемент – это вид атомов с одинаковым положительным зарядом ядра.
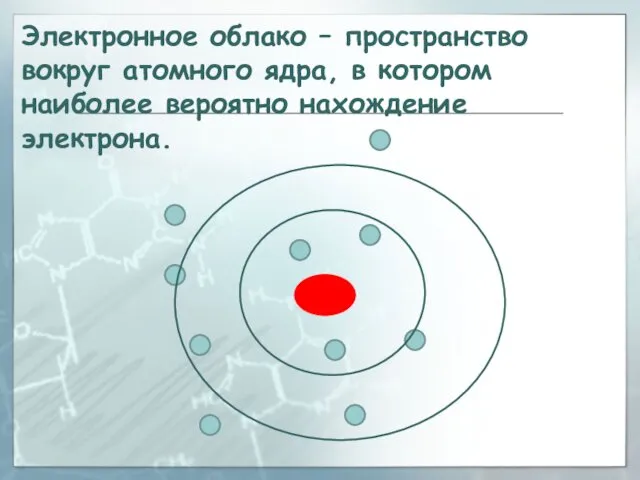
- 26. Электронное облако – пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона.
- 27. Электроны, обладающие близкими значениями энергиями, образуют единый электронный слой.
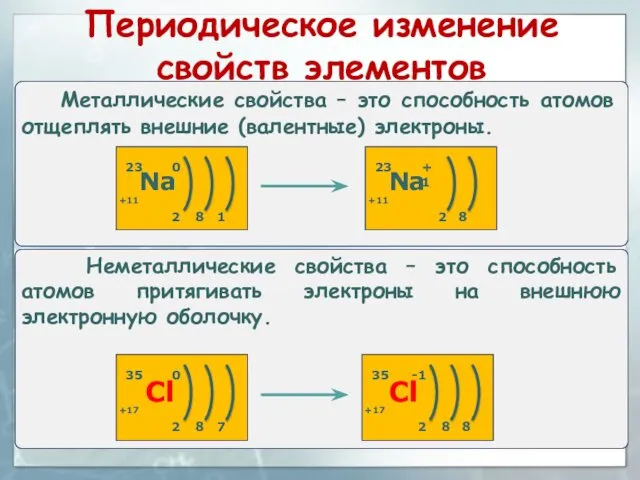
- 28. В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются, так как: а)
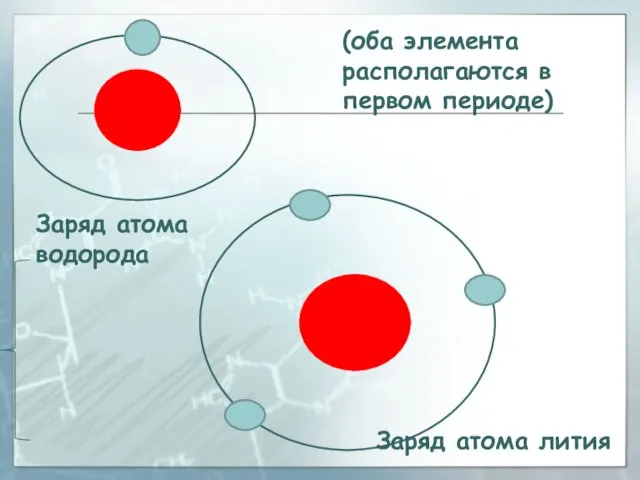
- 29. Заряд атома водорода Заряд атома лития (оба элемента располагаются в первом периоде)
- 30. В пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают,
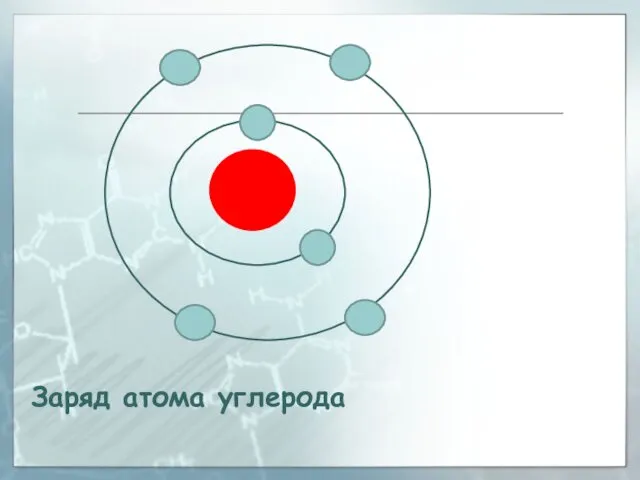
- 31. Заряд атома углерода
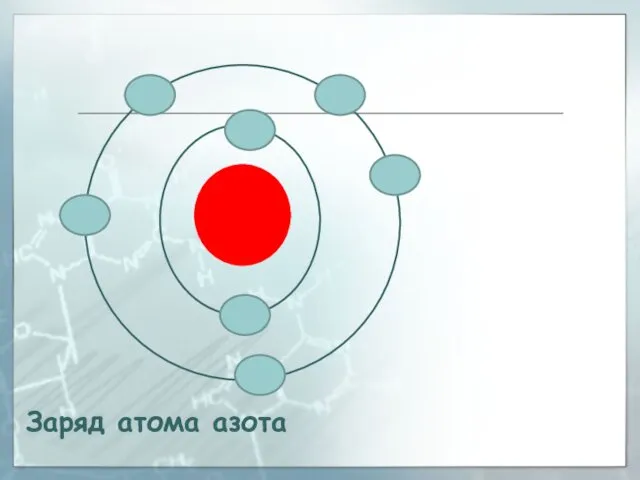
- 32. Заряд атома азота
- 33. Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение
- 34. Характерной особенностью неметаллов является большее число электронов на внешнем энергетическом уровне их атомов. Неметаллы имеют высокие
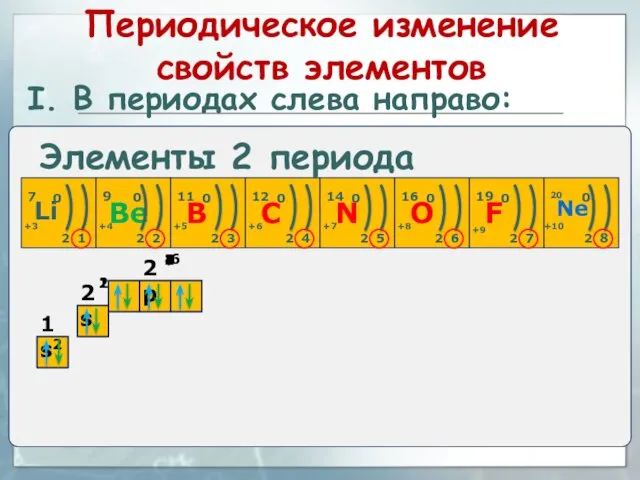
- 35. I. В периодах слева направо: 1 2 1 2 3 4 5 6 Элементы 2 периода
- 36. I. В периодах слева направо: Элементы 2 периода Элементы 3 периода Периодическое изменение свойств элементов
- 37. По своему электронному строению металлы делятся на s-, p-, d- и f-металлы. s-металлы расположены в 1
- 38. Периодическое изменение свойств элементов
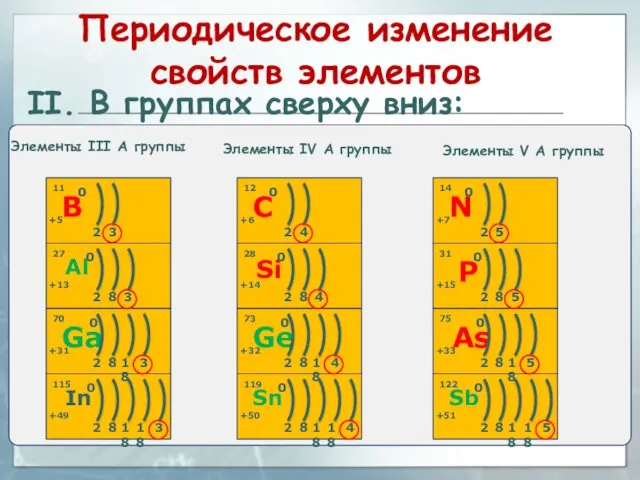
- 39. II. В группах сверху вниз: Элементы IV A группы Элементы V A группы Периодическое изменение свойств
- 41. Типы химических реакций Классификационный признак – число и состав исходных веществ и продуктов реакции
- 42. Реакции разложения Хим.реакции когда из одного исходного вещества образуется несколько более простых веществ. 2НgO ? 2Hg
- 43. Катализаторы Вещества, изменяющие скорость химической реакции, но по окончании их остающиеся качественно и количественно неизменёнными ФЕРМЕНТЫ
- 44. Классификация химических реакций по признаку наличие или отсутствие катализатора Реакции, протекающие с участием катализатора, называются каталитическими.
- 45. Реакции соединения Химические реакции, в результате которых из нескольких исходных веществ образуется одно сложное (продукт реакции)
- 46. Реакции соединения 2SO2 + O2 2SO3 Химические реакции, которые протекают одновременно в двух противоположных направлениях –
- 47. Реакции замещения Zn + 2HCl ? ZnCl2 + H2 2Al + 6HCl ? 2AlCl3 + 3H2
- 48. Вытеснительный ряд Бекетова (ряд активности (напряжений) металлов) Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn,
- 49. Реакции обмена 2NaOH + CuSO4 ? Cu(OH)2 + Na2SO4 2NaI + Pb(NO3)2 ? PbI2 + 2NaNO3
- 50. Реакции обмена Протекают в растворах до конца, если в продуктах реакции образуется: А) вещество выпадающее в
- 51. Реакции обмена H+ - среда кислая ОН- - среда щелочная H+ + ОН- ? H2O –
- 53. Скачать презентацию

































 Кислоты, их состав и названия
Кислоты, их состав и названия Обмен липидов
Обмен липидов Роль воды в химических реакциях
Роль воды в химических реакциях Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары
Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары Непредельные углеводороды. Этилен и его гомологи
Непредельные углеводороды. Этилен и его гомологи Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) IV группа главная подгруппа
IV группа главная подгруппа Хімічні явища в побуті. 7 клас
Хімічні явища в побуті. 7 клас Виды химических связей и типы кристаллических решеток
Виды химических связей и типы кристаллических решеток Углерод и его соединения
Углерод и его соединения Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени Неметаллические материалы
Неметаллические материалы Чистые вещества и смеси. 8 класс
Чистые вещества и смеси. 8 класс Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро
Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро Производство полимеров
Производство полимеров Основания. Неорганические соединения
Основания. Неорганические соединения Полиэтилен — термопластичный полимер этилена
Полиэтилен — термопластичный полимер этилена Кислотно-основное титрование
Кислотно-основное титрование Состояние радионуклидов в различных фазах и методы его изучения
Состояние радионуклидов в различных фазах и методы его изучения Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Обучение в сотрудничестве на уроках химии
Обучение в сотрудничестве на уроках химии Ароматические азотсодержащие соединения
Ароматические азотсодержащие соединения Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации Кристаллы. Выращивание кристалла
Кристаллы. Выращивание кристалла Строение и свойства аминокислот и белков
Строение и свойства аминокислот и белков Автомобильные пластичные смазки
Автомобильные пластичные смазки Игра Химические элементы (формулы и названия)
Игра Химические элементы (формулы и названия) Окислительновосстановительное титрование
Окислительновосстановительное титрование