Содержание
- 2. Майже все, що оточує людину, можна описати кількісними характеристиками Як порахувати 1 200 тістечок для всіх
- 3. Майже все, що оточує людину, можна описати кількісними характеристиками Потрібно знати, скільки тістечок у коробці і
- 4. При проведенні хімічних реакцій хімікам важливо знати співвідношення реагуючих речовин із тим, щоб при проходженні реакції
- 5. Кількість речовини – це фізична величина, яка показує, скільки найменших частинок (атомів, молекул, йонів) даної речовини
- 6. Скільки структурних частинок містить один моль речовини?
- 7. 1 моль речовини містить 6,02⋅1023 структурних частинок (атомів, молекул чи йонів). Ця величина називається «сталою Авогадро»,
- 8. Чому саме таке число обране для визначення моля?
- 9. 1 моль – це кількість речовини, що містить стільки ж структурних частинок, скільки міститься атомів у
- 10. Чи буде однаково виглядати 1 моль різних речовин?
- 11. Цукор 342 г Різні речовини кількістю речовини 1 моль Маса і об’єм 1 моль різних речовин
- 12. 2Н2 + O2 = 2Н2О 2 моль водню 1 моль кисню 2 моль води 4 моль
- 13. Розглянемо приклади задач Формули, що їх будемо використовувати, слід запамятати! N = ν • NА де
- 14. Задача 1. Скільки атомів Фосфору міститься у зразку червоного фосфору кількістю речовини 0,5 моль? Дано: ν
- 15. Задача 2. У кімнаті міститься 2,76 ⋅1026 молекул кисню. Визначте кількість речовини кисню у кімнаті. Дано:
- 16. Задача 3 . Визначте число атомів Оксигену і Гідрогену, що містяться у 5 моль води. Дано:
- 17. Задача 4. Скільки атомів Сульфуру містить 2 моль сірки? Дано: ν (S) = 2 моль Знайти:
- 18. Задача 5. Скільки молекул містить порція води кількістю речовини 3 моль? Дано: ν (Н2О) = 3
- 19. Задача 6. Скільки атомів Р і О і молекул міститься у фосфор(V) оксиді Р2О5 кількістю речовини
- 20. Підведемо підсумки! Кількість речовини – це фізична величина, яка показує, скільки найменших частинок (атомів, молекул, йонів)
- 21. 1. Скільки молекул і атомів міститься в: а) натрій гідроксиді кількістю речовини 1,25 моль б) калій
- 22. У Давньому Римі з простої речовини було зроблено водопровід, монети, кухонний посуд. Це призвело до масового
- 23. Назва цього металічного елемента походить від імені непосидючого бога торгівлі Гермеса. Просту речовину знали ще давньогрецькі
- 24. У лабораторії відомої жінки-хіміка, двічі лауреата Нобелівської премії Марії Складовської-Кюрі одного разу розбився термометр. Пари ртуті
- 26. Скачать презентацию





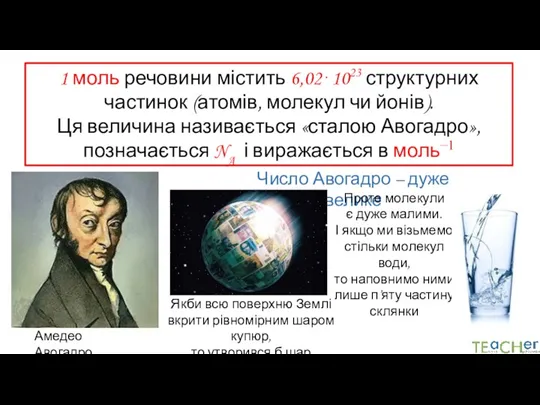

















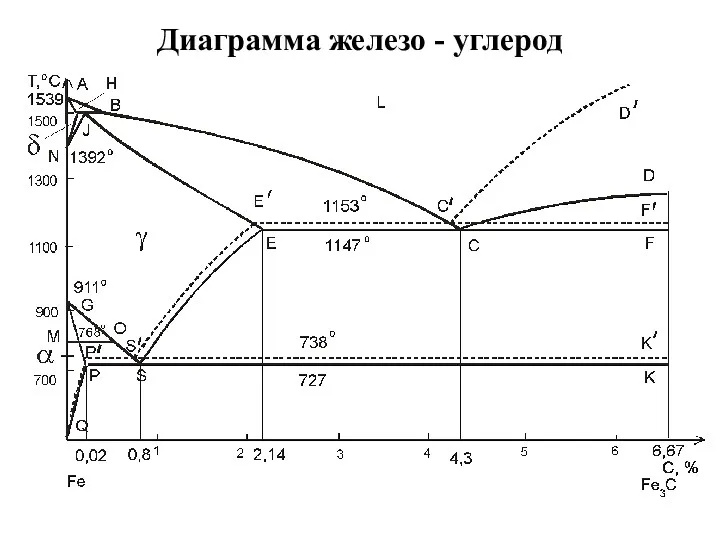 Диаграмма железо - углерод
Диаграмма железо - углерод Соли. Определение солей
Соли. Определение солей Месторождения турмалина
Месторождения турмалина Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс
Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс Алюминий IIIА топ элементі
Алюминий IIIА топ элементі Расчеты по химическим уравнениям. 8 класс
Расчеты по химическим уравнениям. 8 класс Катализ. Классификация каталитических процессов. Механизм действия катализаторов
Катализ. Классификация каталитических процессов. Механизм действия катализаторов Титриметрический метод анализа
Титриметрический метод анализа Періодична система Д.І.Менделєєва
Періодична система Д.І.Менделєєва Металдар мен бейметалдардың салыстырмалы сипаттамасы
Металдар мен бейметалдардың салыстырмалы сипаттамасы Знаки химических элементов
Знаки химических элементов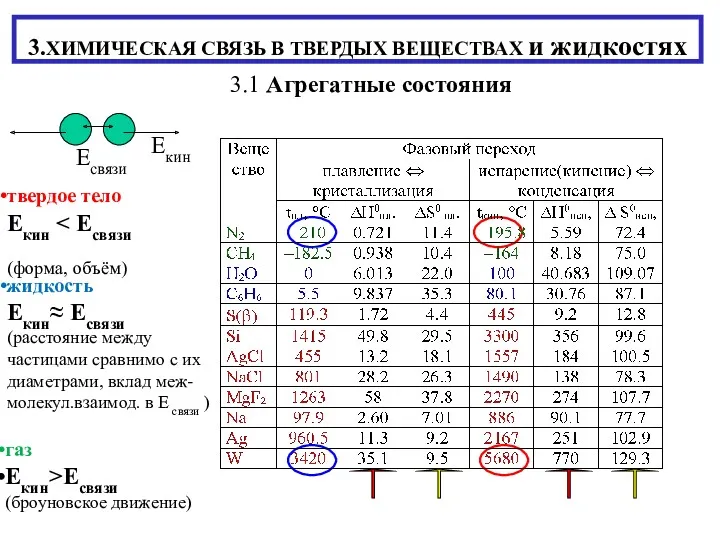 Химическая связь в твердых веществах и жидкостях
Химическая связь в твердых веществах и жидкостях Щелочные металлы
Щелочные металлы Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Задачи, включаемые в задание 33 тестов ЕГЭ
Задачи, включаемые в задание 33 тестов ЕГЭ Аллотропия
Аллотропия Ионная химическая связь
Ионная химическая связь Электролитическая диссоциация
Электролитическая диссоциация Розділ 3. Теорія комплексних сполук. Комплексні сполуки
Розділ 3. Теорія комплексних сполук. Комплексні сполуки Равновесные электрохимические системы
Равновесные электрохимические системы Мінеральні добрива
Мінеральні добрива Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Классификация химических элементов. 8 класс
Классификация химических элементов. 8 класс Титриметрический анализ. Сущность титриметрического анализа
Титриметрический анализ. Сущность титриметрического анализа Липиды
Липиды Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Вода. Химические и физические свойства
Вода. Химические и физические свойства Разделение углеводородных газов
Разделение углеводородных газов