Содержание
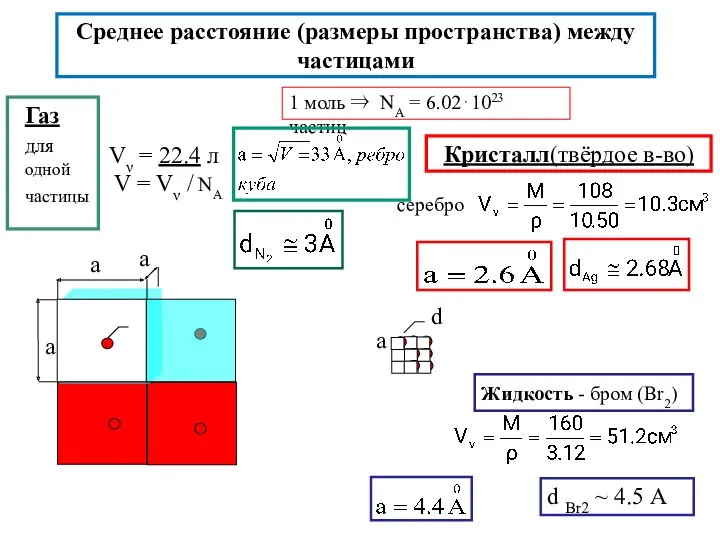
- 2. Среднее расстояние (размеры пространства) между частицами Vν = 22.4 л V = Vν / NA 1
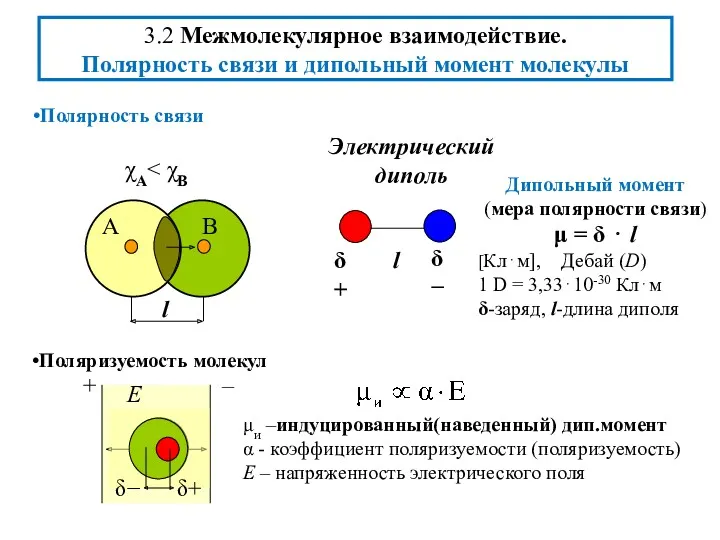
- 3. Полярность связи Дипольный момент (мера полярности связи) μ = δ ⋅ l [Кл⋅м], Дебай (D) 1
- 4. Дипольный момент молекул
- 5. Силы Ван-дер-Ваальса [без обмена электронами, межмолекулярное взаимодействие (притяжение) диполей] 1. Ориентационный эффект (Кьезома) (взаимодействие(электростатическое притяжение) пост.диполь
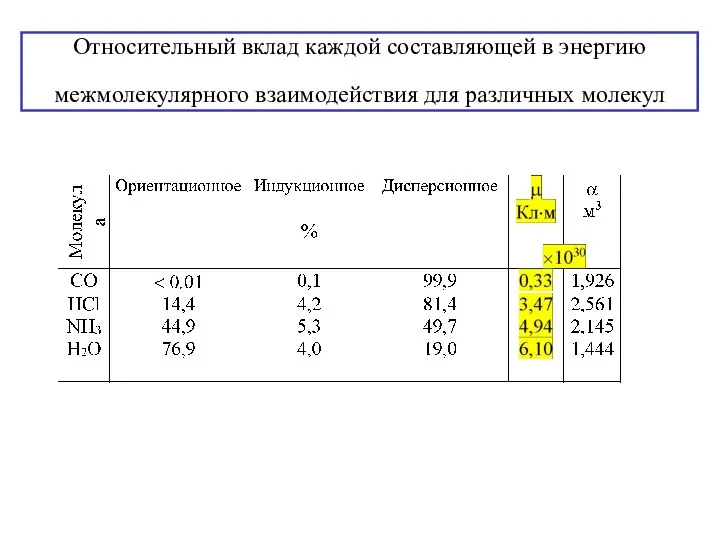
- 6. Относительный вклад каждой составляющей в энергию межмолекулярного взаимодействия для различных молекул
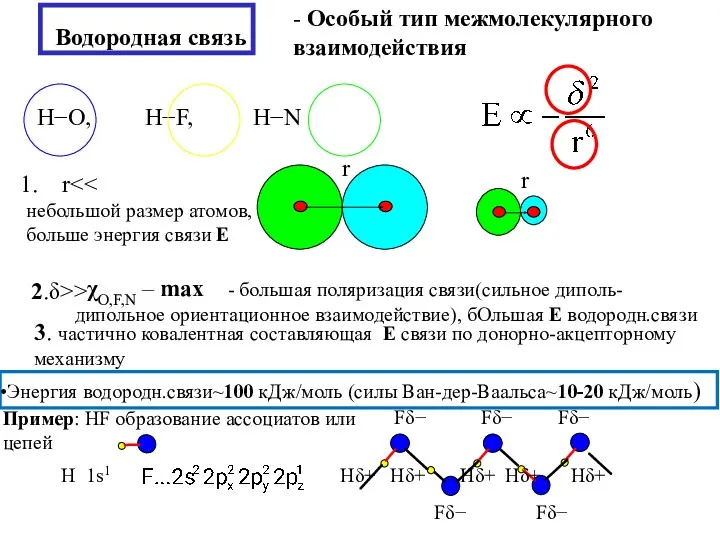
- 7. Водородная связь - Особый тип межмолекулярного взаимодействия r небольшой размер атомов, больше энергия связи Е 2.δ>>
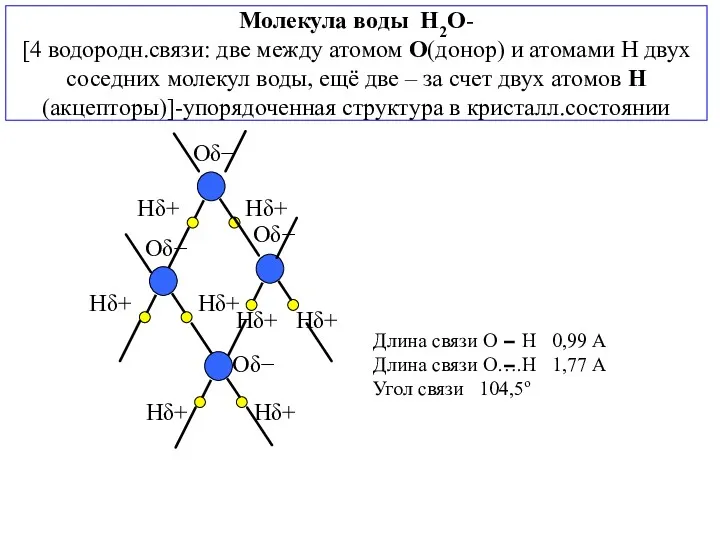
- 8. Молекула воды H2O- [4 водородн.связи: две между атомом О(донор) и атомами Н двух соседних молекул воды,
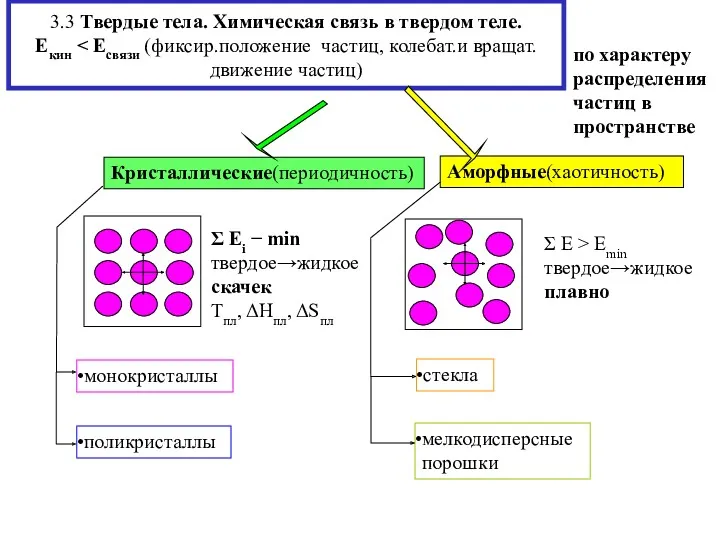
- 9. 3.3 Твердые тела. Химическая связь в твердом теле. Екин по характеру распределения частиц в пространстве
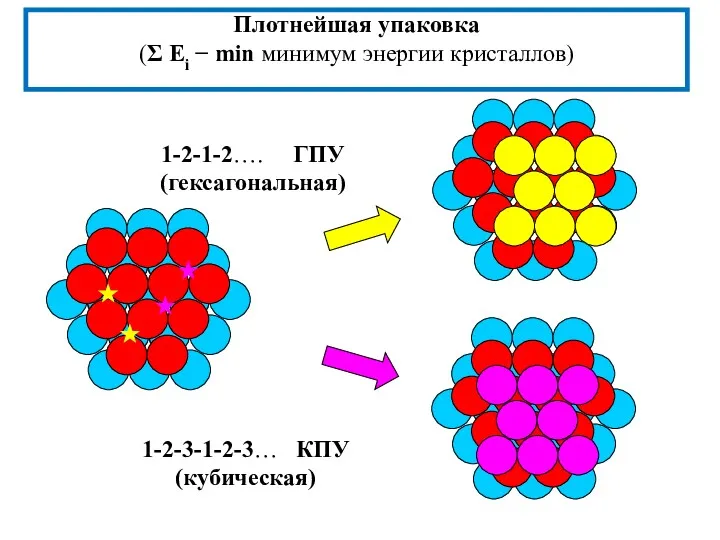
- 10. Плотнейшая упаковка (Σ Еi − min минимум энергии кристаллов) 1-2-1-2…. ГПУ(гексагональная) 1-2-3-1-2-3… КПУ(кубическая)
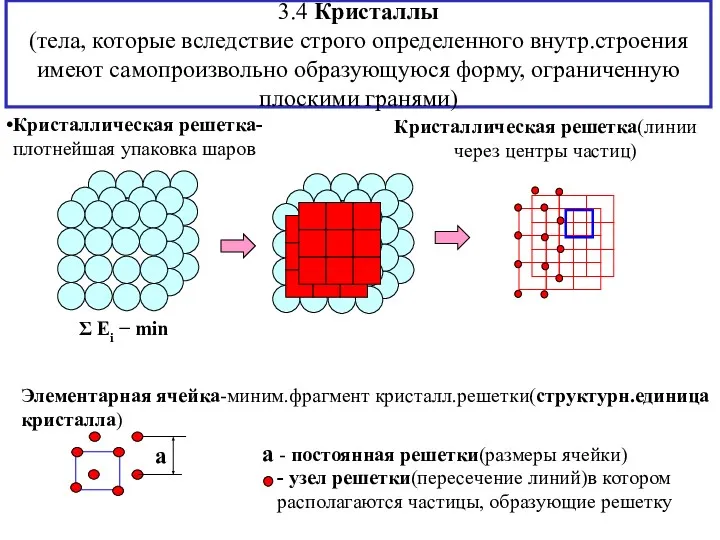
- 11. 3.4 Кристаллы (тела, которые вследствие строго определенного внутр.строения имеют самопроизвольно образующуюся форму, ограниченную плоскими гранями) Кристаллическая
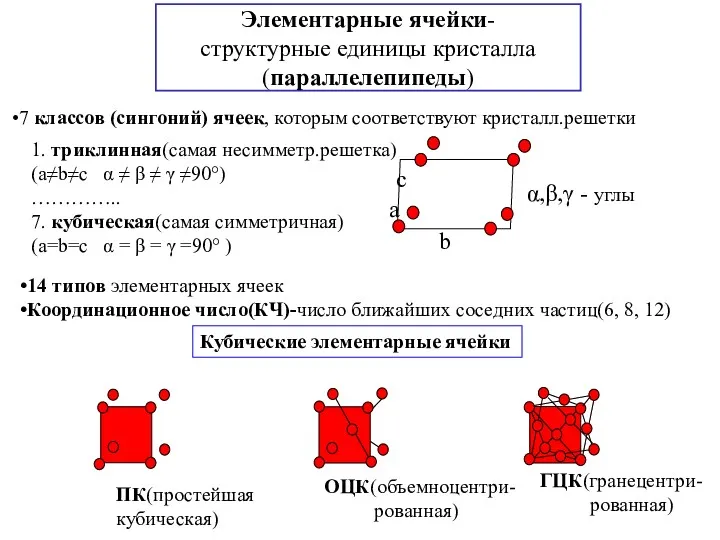
- 12. Элементарные ячейки- структурные единицы кристалла (параллелепипеды) 7 классов (сингоний) ячеек, которым соответствуют кристалл.решетки 1. триклинная(самая несимметр.решетка)
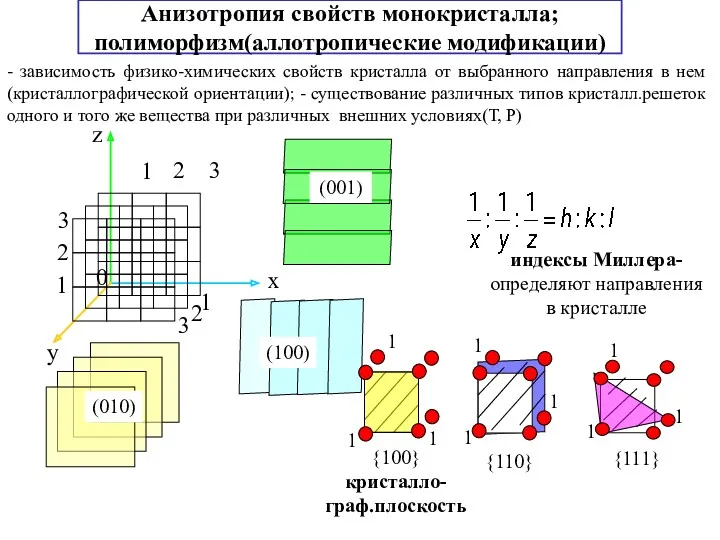
- 13. Анизотропия свойств монокристалла; полиморфизм(аллотропические модификации) - зависимость физико-химических свойств кристалла от выбранного направления в нем(кристаллографической ориентации);
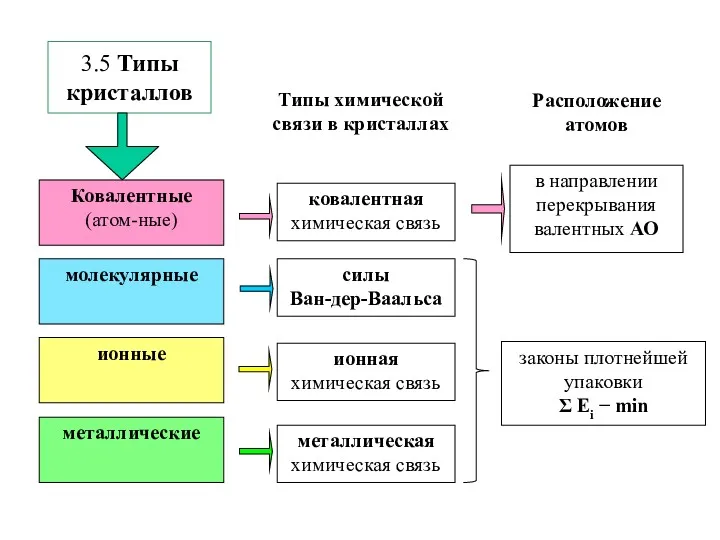
- 14. 3.5 Типы кристаллов молекулярные ионные металлические Ковалентные(атом-ные) Типы химической связи в кристаллах Расположение атомов
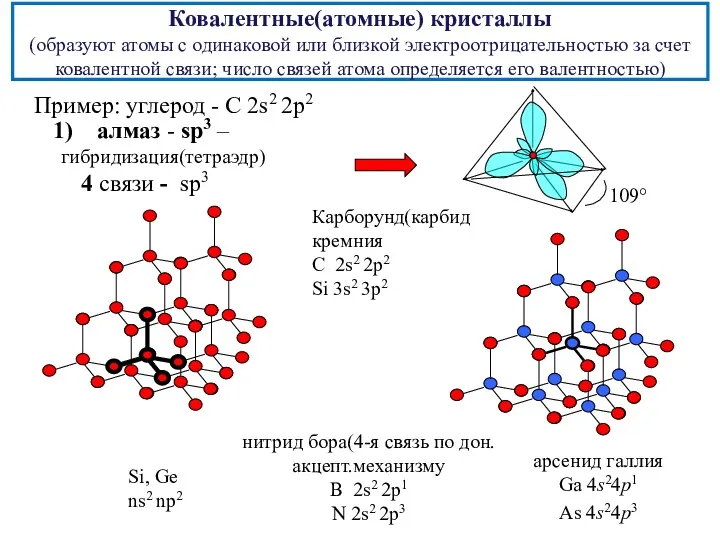
- 15. Ковалентные(атомные) кристаллы (образуют атомы с одинаковой или близкой электроотрицательностью за счет ковалентной связи; число связей атома
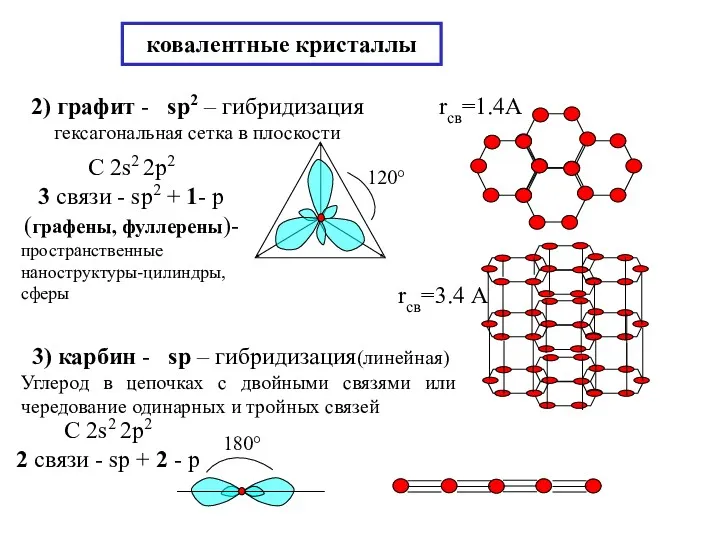
- 16. ковалентные кристаллы 2) графит - sp2 – гибридизация гексагональная сетка в плоскости С 2s2 2p2 3
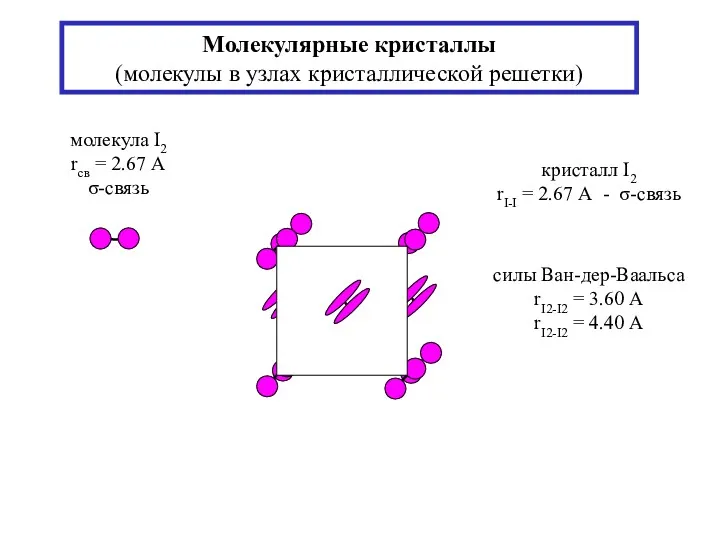
- 17. Молекулярные кристаллы (молекулы в узлах кристаллической решетки) силы Ван-дер-Ваальса rI2-I2 = 3.60 А rI2-I2 = 4.40
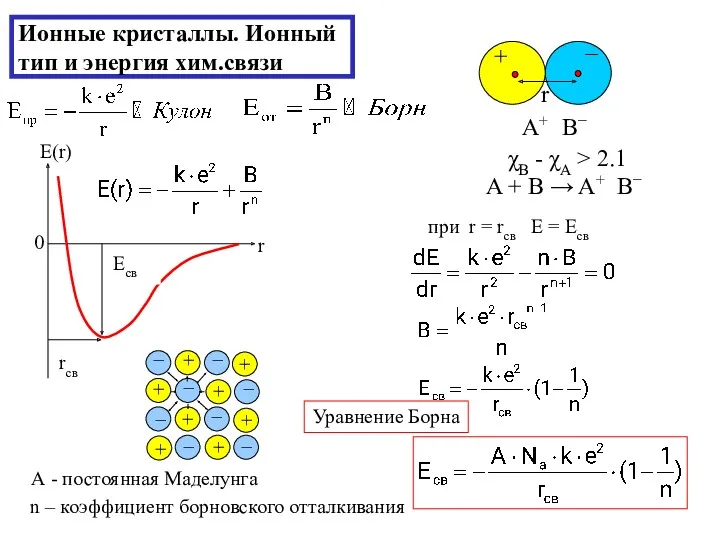
- 18. Ионные кристаллы. Ионный тип и энергия хим.связи χB - χA > 2.1 A + B →
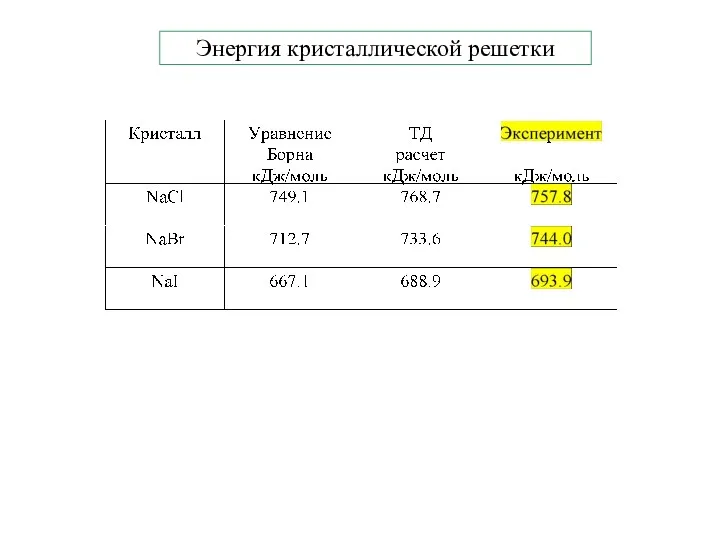
- 19. Энергия кристаллической решетки
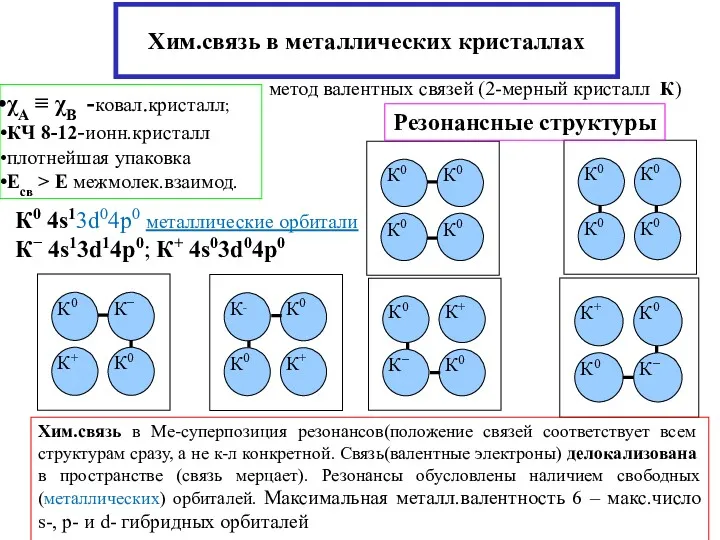
- 20. Хим.связь в металлических кристаллах χA ≡ χB -ковал.кристалл; КЧ 8-12-ионн.кристалл плотнейшая упаковка Есв > Е межмолек.взаимод.
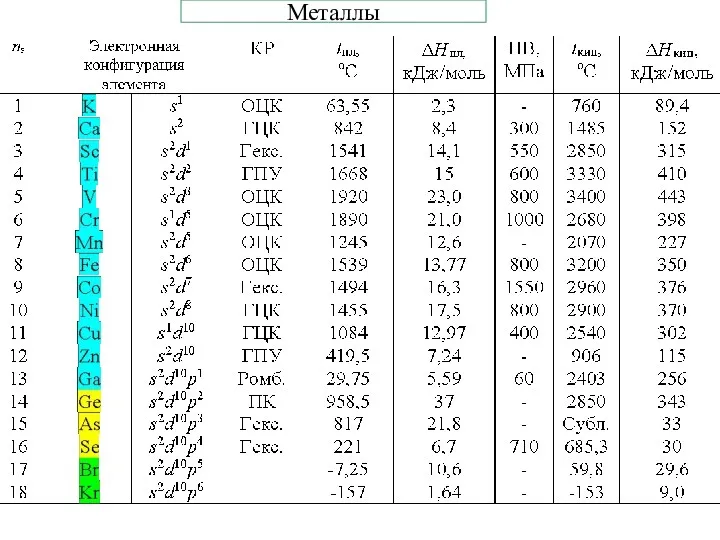
- 21. Металлы
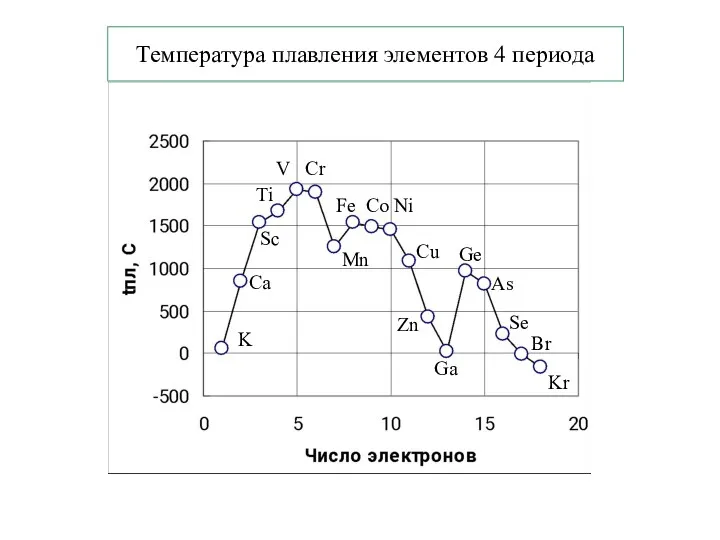
- 22. Температура плавления элементов 4 периода
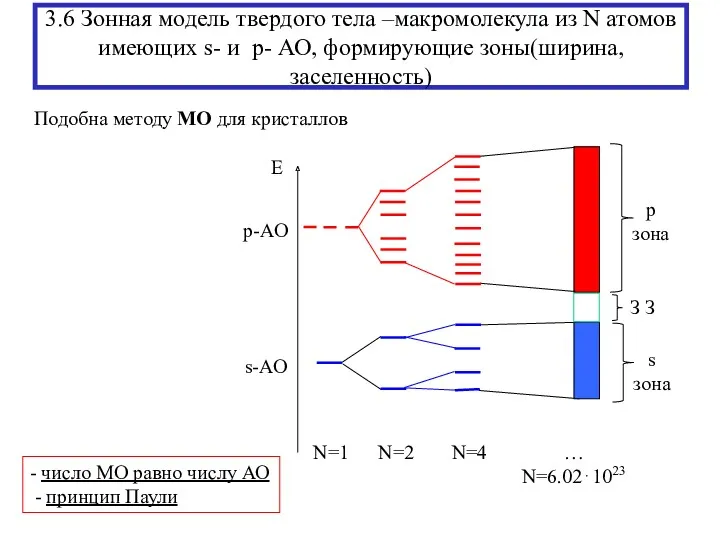
- 23. 3.6 Зонная модель твердого тела –макромолекула из N атомов имеющих s- и p- АО, формирующие зоны(ширина,
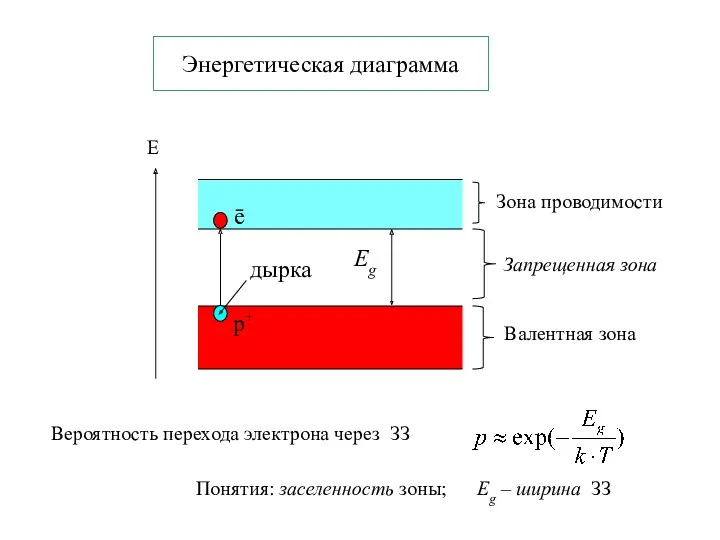
- 24. Энергетическая диаграмма
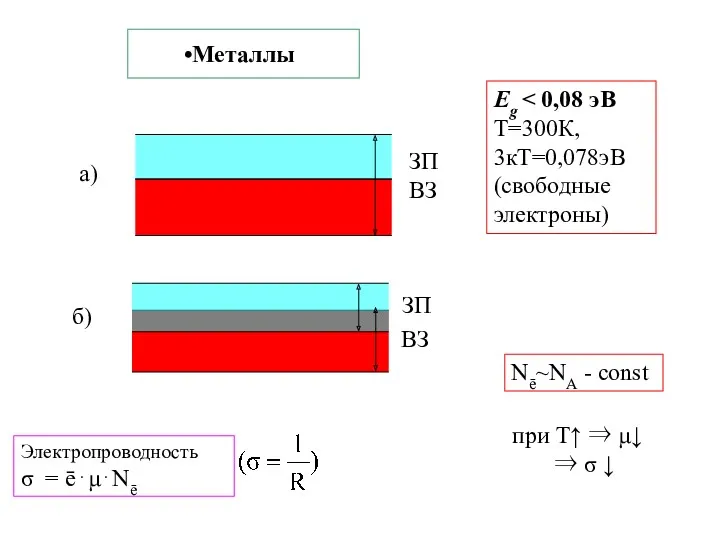
- 25. Металлы Nē~NА - const Eg Т=300К, 3кТ=0,078эВ (свободные электроны) при Т↑ ⇒ μ↓ ⇒ σ ↓
- 26. Eg > > 3 эВ > > кТ- -энергии тепловых колебаний Nē = 0 ⇒ σ
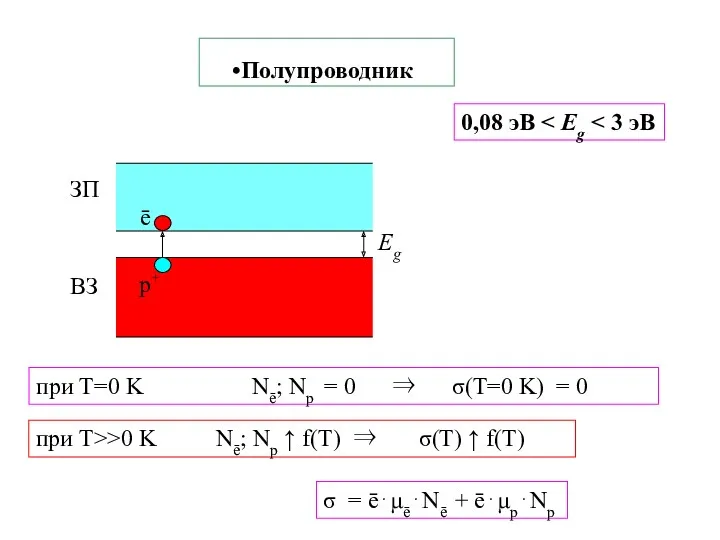
- 27. Полупроводник 0,08 эВ при T=0 K Nē; Nр = 0 ⇒ σ(T=0 K) = 0 σ
- 28. 3.7 Кристаллические материалы Дефекты кристаллической решетки Электронные(электронно-дырочная пара, несимм.разрыв хим.св.) ē-р(А−- А+); Экситоны(без разрыва хим.связи) ex0
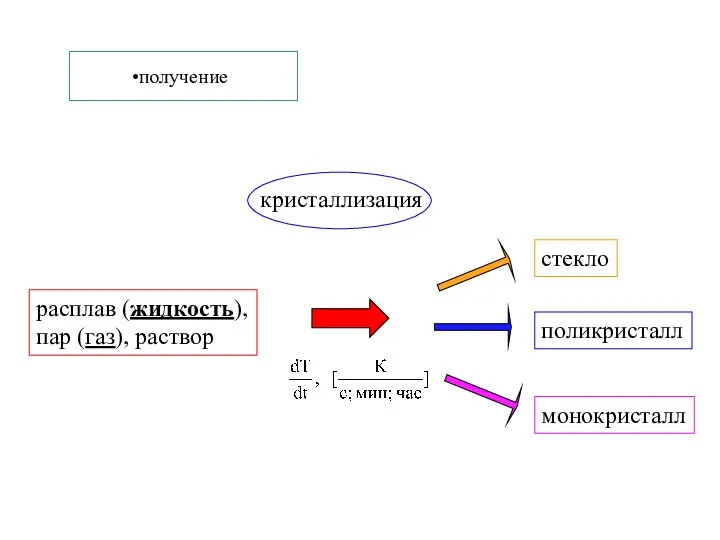
- 29. получение расплав (жидкость), пар (газ), раствор
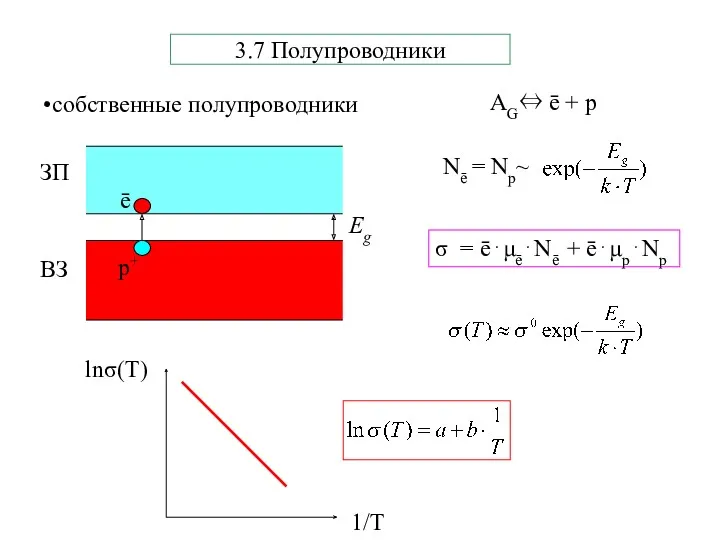
- 30. 3.7 Полупроводники σ = ē⋅μē⋅Nē + ē⋅μр⋅Nр
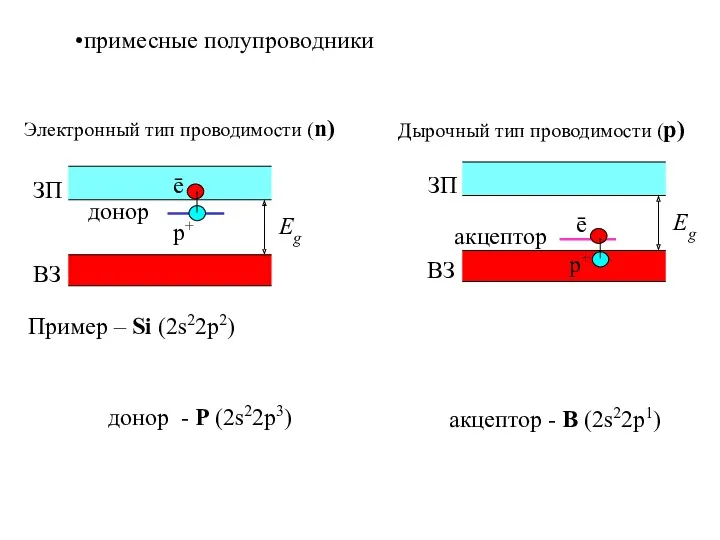
- 31. примесные полупроводники Пример – Si (2s22p2) донор - P (2s22p3) акцептор - B (2s22p1) Электронный тип
- 33. Скачать презентацию

![Силы Ван-дер-Ваальса [без обмена электронами, межмолекулярное взаимодействие (притяжение) диполей] 1.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/272070/slide-4.jpg)


 Липиды
Липиды Період як особлива синтаксична конструкція
Період як особлива синтаксична конструкція Глицерин. Свойства и применение
Глицерин. Свойства и применение Крекинг нефти
Крекинг нефти Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи
Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи Химическая связь
Химическая связь Приготовление растворов солей с определенной массовой долей растворенного вещества
Приготовление растворов солей с определенной массовой долей растворенного вещества Вода – это жизнь!
Вода – это жизнь! The production of stable isotopes
The production of stable isotopes Молибден. Нахождение в природе
Молибден. Нахождение в природе Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук
Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау
Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау Аммиак
Аммиак Что нас объединяет?
Что нас объединяет? Таблицы. Определение характера оксидов
Таблицы. Определение характера оксидов Основи
Основи Методы оценки плотности и вязкости нефтей и нефтепродуктов
Методы оценки плотности и вязкости нефтей и нефтепродуктов Ионное произведение воды. Водородный показатель
Ионное произведение воды. Водородный показатель Ионы и ионная химическая связь
Ионы и ионная химическая связь Металлы главных подгрупп
Металлы главных подгрупп Производство извести
Производство извести Металлы. Свойства металлов
Металлы. Свойства металлов Химия. D-элементтер
Химия. D-элементтер Методы определения вязкости жидкости
Методы определения вязкости жидкости Химический состав клетки
Химический состав клетки Основні класи неорганічних сполук
Основні класи неорганічних сполук Алюминий (лат. Aluminium)
Алюминий (лат. Aluminium) Непредельные углеводороды. Алкины
Непредельные углеводороды. Алкины