Содержание
- 2. Содержание Электролитическая диссоциация воды Ионное произведение воды Водородный показатель (рН) Определение рН водных растворов Буферные растворы
- 3. Диссоциация воды Упрощенная запись уравнения диссоциации воды : H2O H+ + OH− Константа диссоциации воды при
- 4. Ионное произведение воды Kw при Т=298 К При повышении температуры Kw увеличивается Модуль 2. Лекция 9.
- 5. Концентрации ионов H+ и OH− Расчет [H+] и [OH-] в 0,01 М растворе NaOH NaOH =
- 6. Водородный показатель рН pH = -lg [H+] Расчет рН 0,01 М раствора соляной кислоты HCl =
- 7. Расчет рН 0,01 М раствора HBrO HBrO - слабый электролит HBrO H+ + BrO− [H+] =
- 8. Расчет рН 0,01 М раствора аммиака Гидрат аммиака - слабый электролит Модуль 2. Лекция 9. Ионное
- 9. Нейтральная среда Кислая среда Щелочная среда Количественные характеристики среды Модуль 2. Лекция 9. Ионное произведение воды.
- 10. Значения рН в различных средах Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
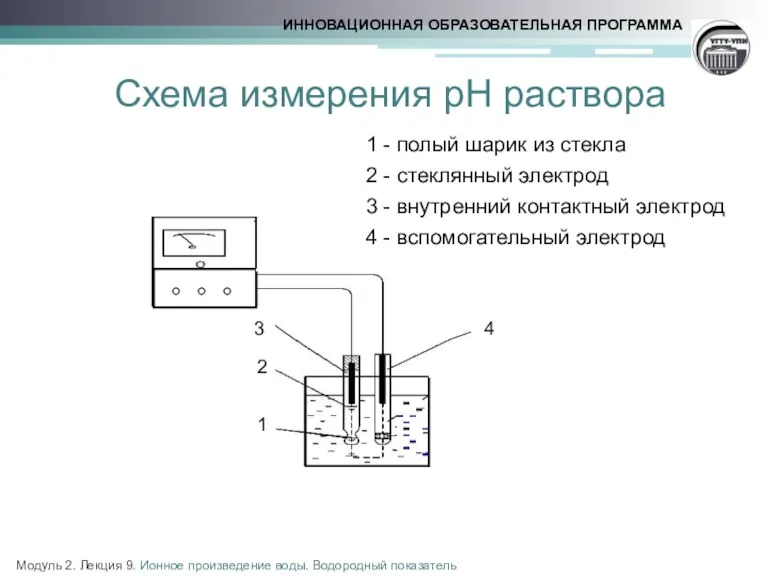
- 11. Схема измерения рН раствора 1 - полый шарик из стекла 2 - стеклянный электрод 3 -
- 12. Прибор для измерения рН рН-метр «ЭКСПЕРТ-рН» Модуль 2. Лекция 9. Ионное произведение воды. Водородный показатель
- 13. Индикатор фенолфталеин преобладает молекулярная форма преобладает ионная форма HInd H+ + Ind- бесцветный малиновый Модуль 2.
- 14. Индикатор метиловый оранжевый преобладает молекулярная форма преобладает ионная форма 1 2 3 4 5 6 7
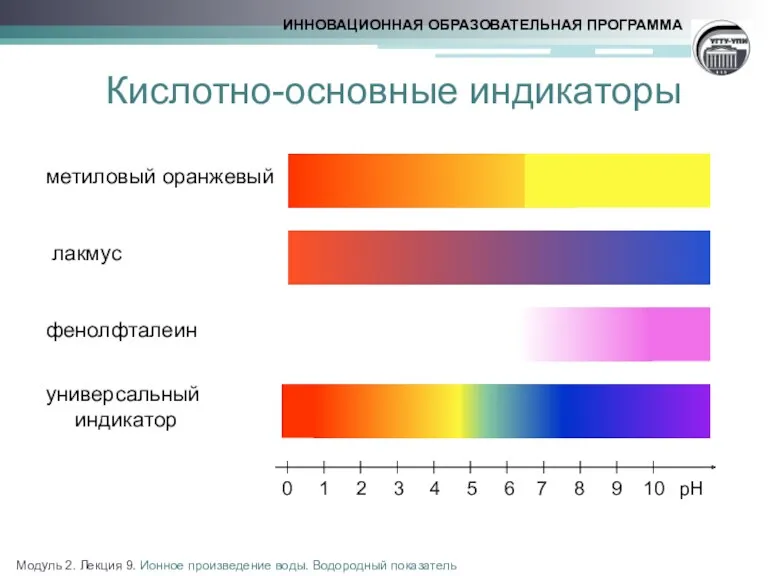
- 15. Кислотно-основные индикаторы метиловый оранжевый лакмус фенолфталеин универсальный индикатор рН 0 1 2 3 4 5 6
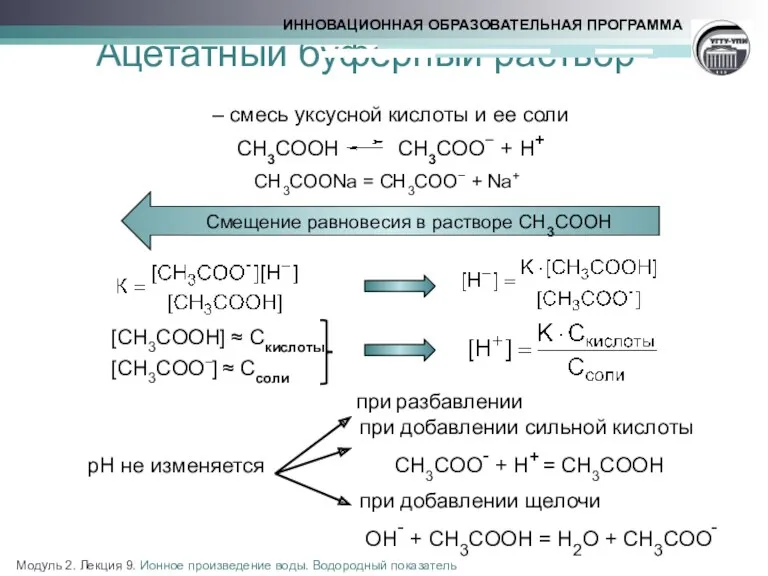
- 16. Ацетатный буферный раствор - – смесь уксусной кислоты и ее соли СН3СООН СН3СОО− + Н+ СН3СООNa
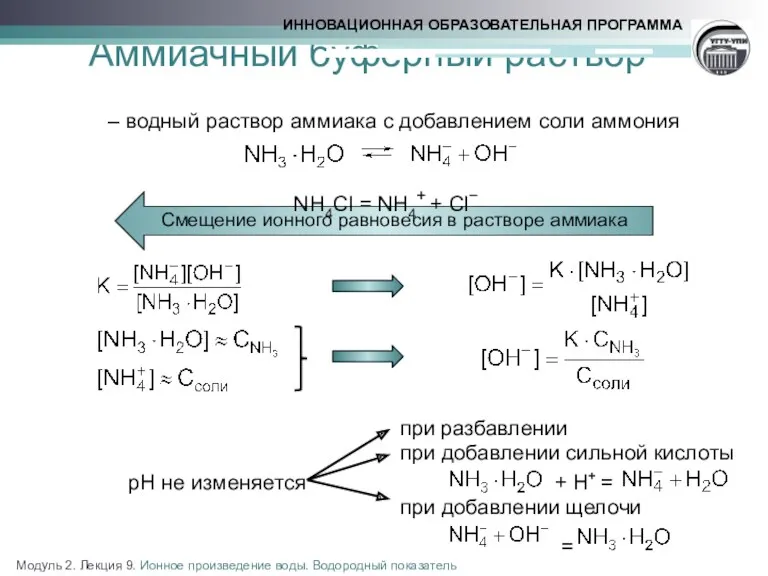
- 17. Аммиачный буферный раствор – – водный раствор аммиака с добавлением соли аммония NН4Cl = NH4+ +
- 18. Заключение Электропроводность чистой воды обусловлена ее автопротолизом. Вода проявляет свойства слабого электролита Для воды и разбавленных
- 20. Скачать презентацию



![Концентрации ионов H+ и OH− Расчет [H+] и [OH-] в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/439157/slide-4.jpg)
![Водородный показатель рН pH = -lg [H+] Расчет рН 0,01](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/439157/slide-5.jpg)








 Гетероциклдық қосылыстардың туындылары
Гетероциклдық қосылыстардың туындылары Непредельные углеводороды этиленового ряда (олефины, алкены)
Непредельные углеводороды этиленового ряда (олефины, алкены) План характеристики елемента за його положенням у періодичній системі та будовою атома
План характеристики елемента за його положенням у періодичній системі та будовою атома Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Biomass Feedstocks
Biomass Feedstocks Химическая взрывчатка
Химическая взрывчатка Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода
Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода Оксиды, их классификация и свойства (8 класс)
Оксиды, их классификация и свойства (8 класс) Практическая работа. Химический состав клетки
Практическая работа. Химический состав клетки Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Закон Авогадро. Молярный объём газов
Закон Авогадро. Молярный объём газов Значення хімії у повсякденному житті
Значення хімії у повсякденному житті Пегматитовые месторождения
Пегматитовые месторождения Строение, свойства и функции белков
Строение, свойства и функции белков Спирты. Виды спирта
Спирты. Виды спирта Геохимические барьеры
Геохимические барьеры Классификация органических соединений
Классификация органических соединений Азотсодержащие соединения
Азотсодержащие соединения Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку
Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку Водород. Химический знак - H
Водород. Химический знак - H Проект: жило-было мыло
Проект: жило-было мыло Электрохимический ряд напряжений металлов. Свойства металлов
Электрохимический ряд напряжений металлов. Свойства металлов Магний и кальций
Магний и кальций Водород. Нахождение в природе. Физические и химические свойства. Применение
Водород. Нахождение в природе. Физические и химические свойства. Применение Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі
Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі Группа веществ, изолируемых из биологического материала дистилляцией
Группа веществ, изолируемых из биологического материала дистилляцией Количество вещества. 8 класс
Количество вещества. 8 класс Железоуглеродистые сплавы
Железоуглеродистые сплавы