Содержание
- 2. Содержание Электронное строение атома Электронное строение атома Mg Строение простого вещества Физические свойства Физические свойства Mg
- 3. Электронное строение атома Mg 24 Mg +12 0 2e 8e 2e 1s2 2s2 2p6 3s2 Краткая
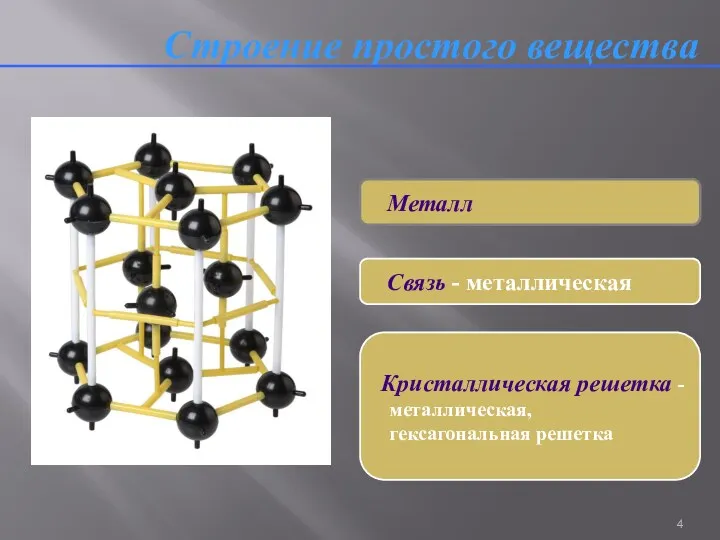
- 4. Строение простого вещества Металл Связь - металлическая Кристаллическая решетка - металлическая, гексагональная решетка
- 5. Физические свойства Mg
- 6. Химические свойства Mg 2Mg + O2 = 2MgO t Mg + S = Mg S C
- 7. Горение Mg в кислороде 2Mg + O2 = 2MgO 2Mg + O2 = 2MgO
- 8. Горение Mg в воде Что будет, если тушить магний водой? На заводе по переработке вторичного сырья
- 9. Горение Mg в хлоре Mg + Cl2 = MgCl2
- 10. Вспышка смеси Mg + AgNO3 от капли воды 3Mg + AgNO3 = 3MgO + 0.5N2 +
- 11. Лабораторная работа: «Горение магния на воздухе» 2Mg + O2 = 2MgO
- 12. Магнийтермия Магнийтермия – получение металлов восстановлением оксидов металлов магнием, которое сопровождается выделением значительного количества теплоты. 4Mg+
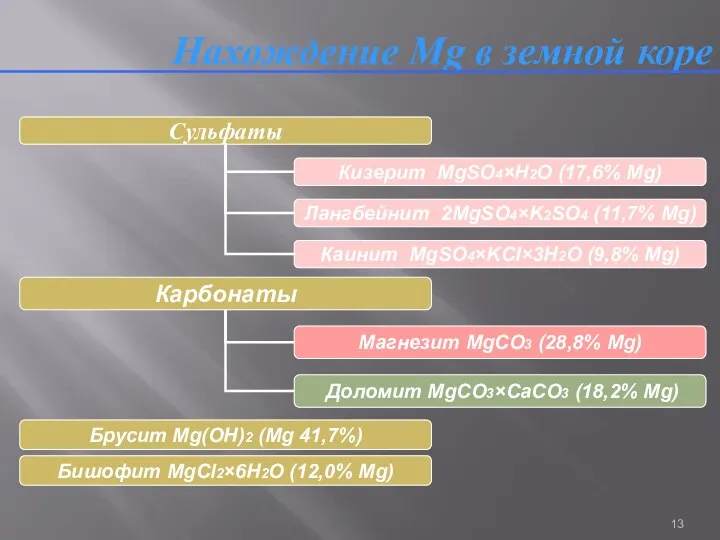
- 13. Нахождение Mg в земной коре
- 14. Получение Mg
- 15. Применение Mg и его сплавов
- 16. Выводы Магний – химический элемент II группы ПСХЭ Д.И. Менделеева, в химическом отношении – весьма активный
- 17. КАЛЬЦИЙ И ЕГО СОЕДИНЕНИЯ
- 18. НАХОЖДЕНИЕ В ПРИРОДЕ Кальцит CaCO3
- 19. АРАГОНИТ CaCO3
- 20. ВАТЕРИТ (ФАТЕРИТ) CaCO3
- 21. Важнейшее соединение: CaCO3
- 22. Важнейшие соединения Гипс CaSO4 ∙ 2H2O Фосфориты и апатиты Ca3(PO4)2
- 23. Физические свойства Серебристо-белый, легкий (p=1,55) t пл. = 851Сᵒ
- 24. Химические свойства Ca + 2H2O =Ca(OH)2 + H2↑ гидроксид кальция Ca + Cl2 = CaCl2 хлорид
- 25. Оксид кальция CaO Ионная кристаллическая решетка СaO – негашеная известь Белое, тугоплавкое вещество (2570Сᵒ)
- 26. Химические свойства Ca(OH)2 -гащеная известь, известковое молоко, известковая вода
- 28. Скачать презентацию























 Серная кислота
Серная кислота Оксиды
Оксиды Химический состав клетки. Неорганические вещества клетки
Химический состав клетки. Неорганические вещества клетки Сполуки неметалічних елементів з Гідрогеном
Сполуки неметалічних елементів з Гідрогеном Milk Composition. Proteins - Молоко
Milk Composition. Proteins - Молоко Приёмы обращения с лабораторным оборудованием и основы техники безопасности
Приёмы обращения с лабораторным оборудованием и основы техники безопасности Кислород
Кислород Химия. Дисперсные системы. Растворы
Химия. Дисперсные системы. Растворы Химические свойства оснований, кислот и солей в свете теории электролитической диссоциации
Химические свойства оснований, кислот и солей в свете теории электролитической диссоциации Минералы и Близнецы
Минералы и Близнецы Гидролиз солей
Гидролиз солей Алкадиены
Алкадиены Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс
Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №15
Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №15 Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Установка по переработке углеводородов
Установка по переработке углеводородов Соли. Формулы солей
Соли. Формулы солей d997-13229e5e
d997-13229e5e Структура легированной стали
Структура легированной стали Изучение состава чая
Изучение состава чая Основания. Гидроксид аммония-NH₃·H₂O
Основания. Гидроксид аммония-NH₃·H₂O Оксиды. Химические свойства и получение оксидов
Оксиды. Химические свойства и получение оксидов Геохимия природных процессов. Геохимическая типизация гранитоидов Л.В. Таусона
Геохимия природных процессов. Геохимическая типизация гранитоидов Л.В. Таусона Полимеры (10 класс)
Полимеры (10 класс) Полімери. Їх властивості та застосування
Полімери. Їх властивості та застосування Экспертные системы распознавания химических веществ
Экспертные системы распознавания химических веществ Электронные конфигурации атомов
Электронные конфигурации атомов Технология оптического стекла
Технология оптического стекла