Содержание
- 2. Которое зовут озоном. И в этом есть большой резон: В грозу запахнет над газоном – От
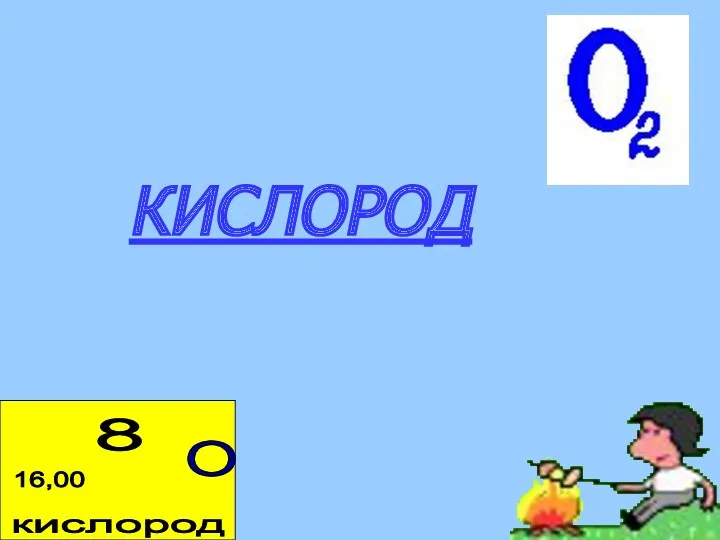
- 3. КИСЛОРОД
- 4. 2. РАСПРОСТРАНЕНИЕ КИСЛОРОДА В ПРИРОДЕ Первое место по распространенности в земной коре, т.е. литосфере, занимает кислород
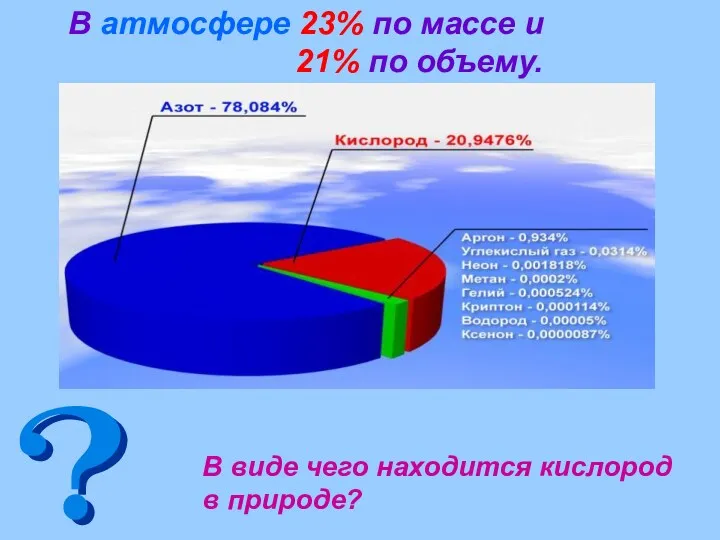
- 5. В атмосфере 23% по массе и 21% по объему. В виде чего находится кислород в природе?
- 6. 3. ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА Кислород – газ, без цвета и запаха, мало растворим в воде, кислород
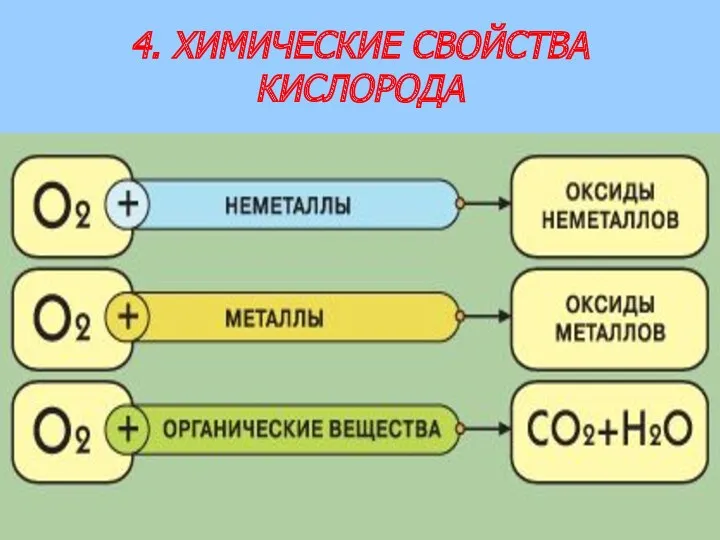
- 7. 4. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
- 8. Кислород - окислитель Под действием кислорода элементы повышают свою валентность!!! 1. Кислород реагирует с неметаллами (кроме
- 9. Кислород - окислитель 3. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды, оксиды
- 10. СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОРОДА 1. В промышленности кислород получают из воздуха. В промышленности кислород получают из воздуха
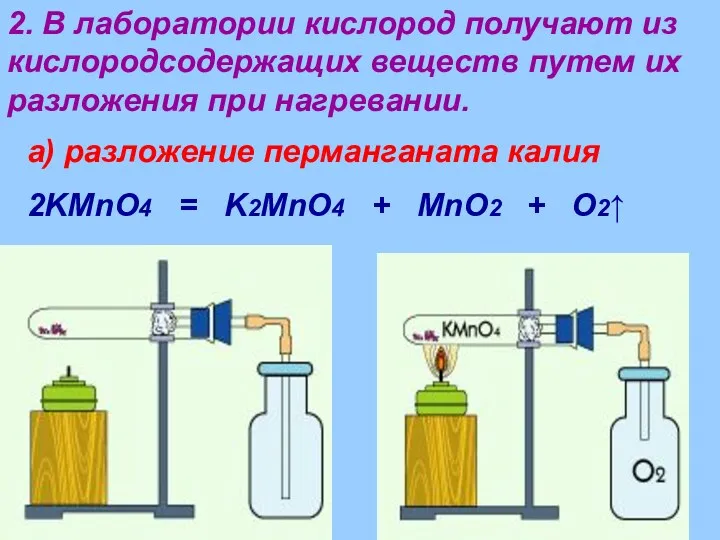
- 11. 2. В лаборатории кислород получают из кислородсодержащих веществ путем их разложения при нагревании. а) разложение перманганата
- 12. б) электролиз воды 2H2O = 2H2↑ + O2↑ в) разложение пероксида водорода 2H2O2 = 2H2O +
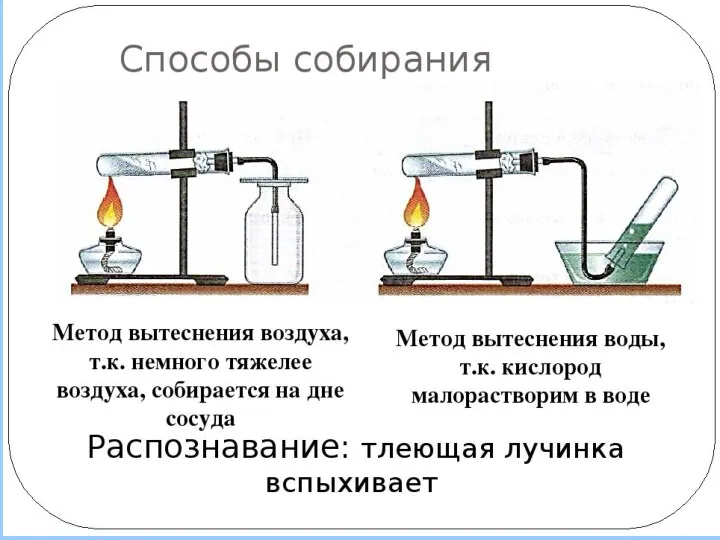
- 13. Способы собирания кислорода Методом вытеснения воды. Так как кислород мало растворим в воде Методом вытеснения воздуха
- 14. Джозеф Пристли (английский ученый) в 1774 году разложением оксида ртути (II) открыл кислород и изучил его
- 16. Скачать презентацию








 Состав, строение и свойства стекла и хрусталя
Состав, строение и свойства стекла и хрусталя Колоїдний захист
Колоїдний захист Свойства химических элементов и закономерность их изменения
Свойства химических элементов и закономерность их изменения Непредельные углеводороды ряда этилена. Олефины
Непредельные углеводороды ряда этилена. Олефины Закон сохранения массы вещества
Закон сохранения массы вещества Электролиз
Электролиз Протолитические равновесия в растворах электролитах
Протолитические равновесия в растворах электролитах Спирты, фенолы, тиолы
Спирты, фенолы, тиолы Производство синтетической нефти
Производство синтетической нефти Алкены. Пропилен C₃H₆
Алкены. Пропилен C₃H₆ Хімічний зв’язок. Типи хімічного зв’язку
Хімічний зв’язок. Типи хімічного зв’язку Термохимия. Термохимические уравнения
Термохимия. Термохимические уравнения Електроліз. Найпоширеніші способи застосування
Електроліз. Найпоширеніші способи застосування Азотсодержащие соединения
Азотсодержащие соединения Классификация химических реакций, протекающих с изменением состава веществ
Классификация химических реакций, протекающих с изменением состава веществ Химические свойства неорганических соединений
Химические свойства неорганических соединений Виды химической связи
Виды химической связи Общая характеристика неметаллов
Общая характеристика неметаллов p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении Соединения железа
Соединения железа Химическая связь
Химическая связь Карбоновые кислоты
Карбоновые кислоты Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Открытие бензола
Открытие бензола Водород. Положение в периодической системе
Водород. Положение в периодической системе Лихеоиндикация. Экологические аспекты переработки полимеров
Лихеоиндикация. Экологические аспекты переработки полимеров Чистые вещества и смеси
Чистые вещества и смеси