Слайд 2

РЕМОНТ
Свойства химических элементов:
Каждый атом стремиться завершить свой внешний энергетический уровень.
Для этого он может либо отдать электроны с внешнего уровня, либо принять недостающие электроны, забрав их у других атомов.
Слайд 3
Слайд 4
Слайд 5

РЕМОНТ
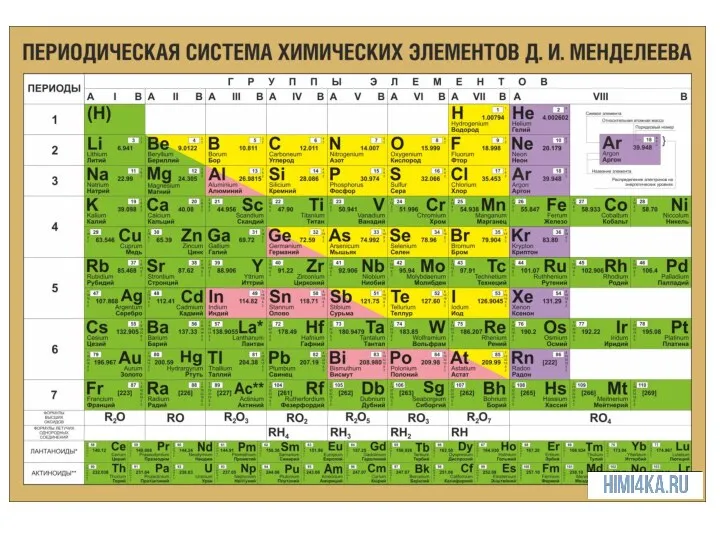
Если на внешнем энергетическом уровне атома находится от 1 до 3
е, атом будет отдавать их, проявляя восстановительные свойства.
Если атом имеет большой радиус, он также легко отдает е, даже если их больше 3.
Это атомы металлов.
Особенности строения атомов определяют расположение металлов в левом нижнем углу ПСХЭ. В правом верхнем углу металлы расположены в побочных подгруппах.
Слайд 6

РЕМОНТ
Атомы неметаллов имеют 4-8 электронов на внешнем уровне и маленькие радиусы,
им легче принять е, чем отдать, проявляя при окислительные свойства, поэтому располагаются в правом верхнем углу ПСХЭ (в главных подгруппах)
Слайд 7
Слайд 8

РЕМОНТ
Изменение свойств элементов по группам и периодам
Слайд 9

Слайд 10
РЕМОНТ
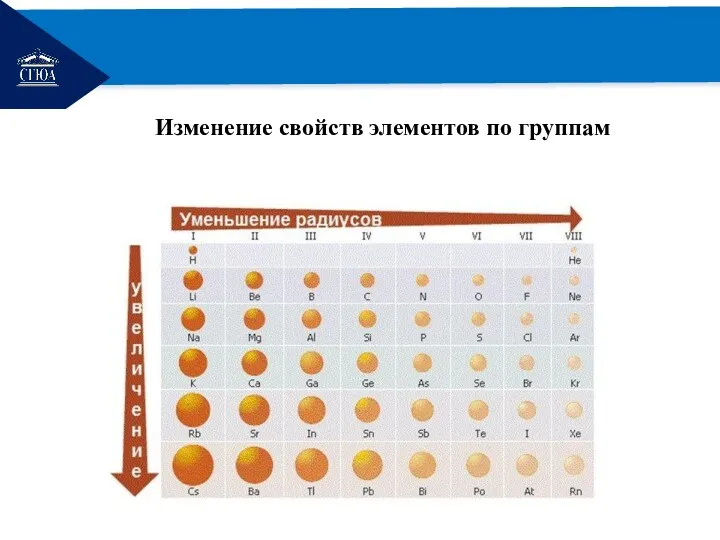
Изменение свойств элементов по группам
Слайд 11

РЕМОНТ
В группах сверху вниз
Увеличивается число энергетических уровней и => радиус
атома;
Ослабевает связь электронов внешнего энергетического уровня с ядром;
Усиливается способность атома отдавать электроны, т.е. усиливаются восстановительные свойства элементов;
Усиливаются металлические свойства элементов
Слайд 12

РЕМОНТ
Закономерности изменения свойств соединений хим. элементов в главных подгруппах сверху вниз:
-
Усиливаются основные свойства высших оксидов и соответствующих гидроксидов, а кислотные — ослабевают
Слайд 13
РЕМОНТ
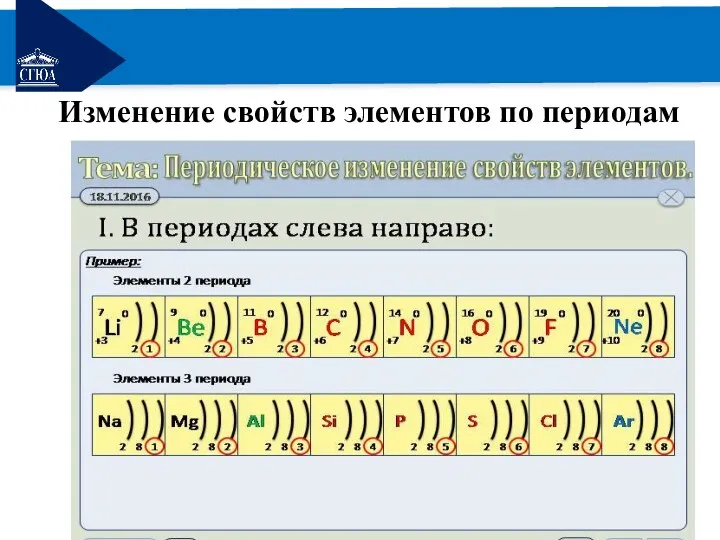
Изменение свойств элементов по периодам
Слайд 14

РЕМОНТ
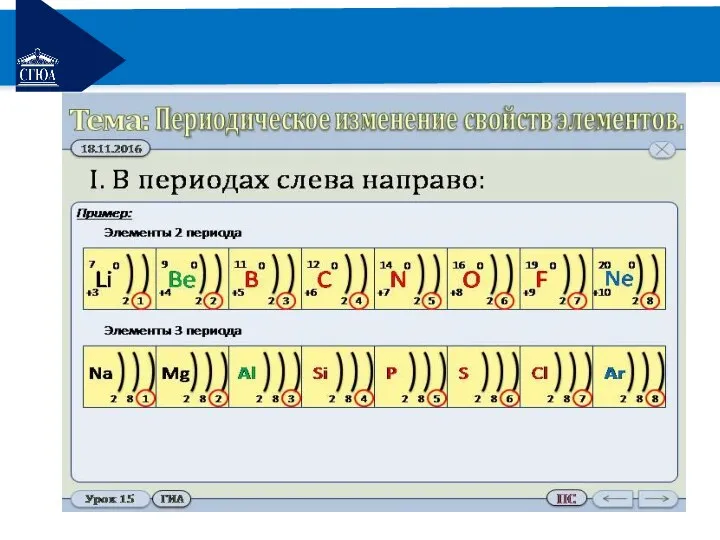
В периодах слева направо
Увеличивается заряд ядра;
Увеличивается число е на внешнем уровне;
Усиливается
притяжение е к ядру;
Уменьшается радиус атома;
Возрастает способность атомов принимать е, т.е. увеличивается электроотрицательность хим. элементов;
Усиливаются окислительные свойства элементов;
Усиливаются неметаллические свойства элементов
Слайд 15
Слайд 16

РЕМОНТ
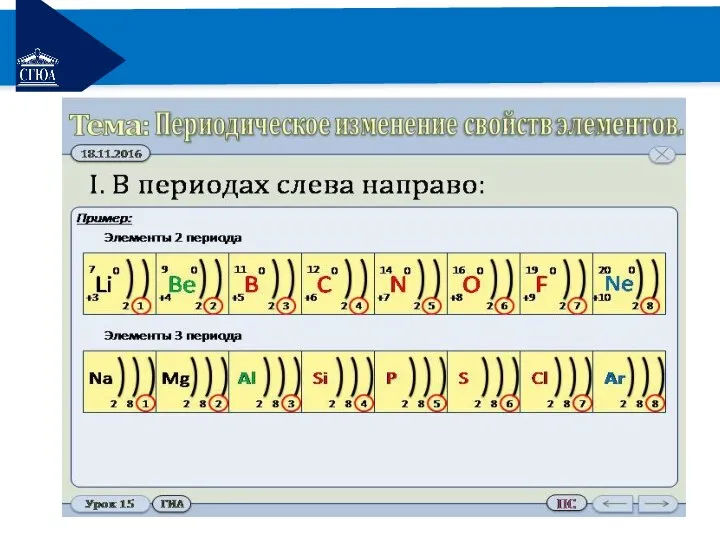
Закономерности изменения свойств соединений хим. элементов в периодах слева направо:
- свойства
высших оксидов и соответствующих гидроксидов изменяются от основных через амфотерные к кислотным;
атомы металлов с водородом образуют нелетучие соединения;
атомы неметаллов образуют летучие водородные соединения
Слайд 17
Слайд 18

РЕМОНТ
Современная формулировка Периодического закона
Слайд 19

РЕМОНТ
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости
от зарядов их атомных ядер
Слайд 20

РЕМОНТ
Физический смысл заряда ядра атома заключается в следующем:
Заряд ядра Z =
число протонов Np = число электронов Ne
Слайд 21

РЕМОНТ
Химические элементы одного периода характеризуются одинаковым числом заполняемых энергетических уровней, равным
номеру периода.
Каждый период начинается щелочным металлом (1 е). Т.е. начало каждого периода совпадает с началом заполнения е нового энергетического уровня
Периодичность изменения свойств хим. элементов объясняется периодическими изменениями числа е на внешних уровнях атомов.
Слайд 22

РЕМОНТ
Таким образом, с ростом заряда ядра происходит периодическое изменение строения электронных
оболочек атомов, что вызывает периодическое изменение свойств химических элементов и их соединений
Слайд 23

РЕМОНТ
Современная формулировка Периодического закона
Свойства химических элементов и образованных ими веществ находятся
в периодической зависимости от периодичности в изменении конфигураций внешних электронных слоёв атомов химических элементов
Слайд 24

РЕМОНТ
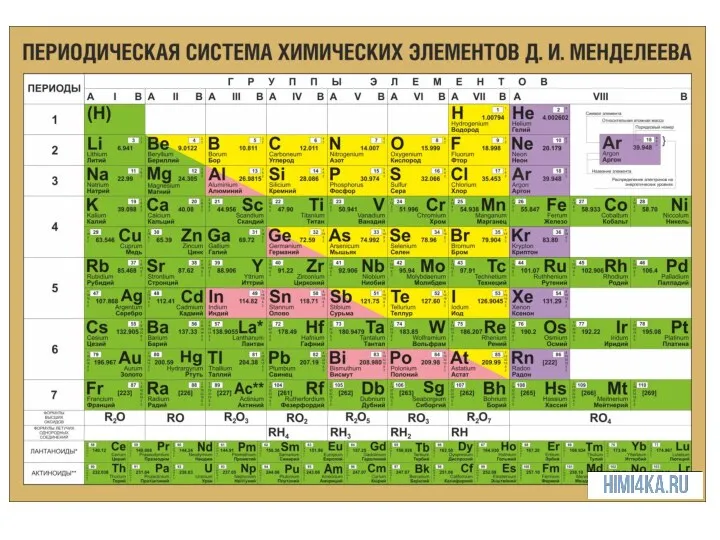
План характеристики элемента по его положению в ПСХЭ
1. Адрес элемента (период,
группа, подгруппа, N).
2. Строение ядра ( заряд, массовое число, число протонов, нейтронов).
3. Строение электронной оболочки (число электронов, электронная схема, электронная формула).
4. Металл или неметалл.
5. Максимальная степень окисления (число отданных электронов = номер группы). Формула высшего оксида, его характер.
6. Минимальная степень окисления (число принятых электронов (У Ме – 0; у неметаллов – (N группы – 8)). Формула летучего водородного соединения.
7. Сравнение с соседями по группе и периоду.
Слайд 25
Слайд 26

РЕМОНТ
Задание
Дать характеристику магнию
(3 период, 2 группа, №12, масса 24)
Слайд 27

РЕМОНТ
Характеристика Мg
3 период, II группа, №12
Z=+12, М=24, р=12, n=12
e = 12
1s22s22p63s2
2 8 2
4. металл
5. Макс. степень окисления: для завершения внешнего слоя отдает 2 е, приобретает степень окисления +2. Высший оксид Мg+2О-2 Основный.
6. Мин. степень окисления у металлов = 0
7. По периоду соседствует с Na и Al. Металлические свойства в периодах слева направо ослабевают
Na> Мg > Al
В группе соседствует с Са и Ве. Металлические свойства сверху вниз усиливаются Ве < Мg<Са
Слайд 28

РЕМОНТ
Задание
Дать характеристику сере
(3 период, 6 группа, №16, масса 32)
Слайд 29

РЕМОНТ
Характеристика S
3 период, VI группа, №16
Z=16, М=32, р=16, n=16
e = 16
1s22s22p63s2
2 8 6
4. неметалл
5. Макс. степень окисления- для завершения внешнего слоя отдает 6 е, приобретает степень окисления +6. Высший оксид S+6О-23 . Кислотный.
6. Мин. степень окисления - для завершения внешнего слоя принимает 2е, приобретает степень окисления -2. Водородное соединение Н2 +1S-2
7. По периоду соседствует с P и Cl. Неметаллические свойства в периодах слева направо усиливаются Р < S < Сl
В группе соседствует с О и Sе. Неметаллические свойства сверху вниз ослабевают О > S > Sе
Слайд 30

РЕМОНТ
Задание:
Дать характеристику по положению в ПСХЭ углероду и литию





























 Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Элементы термодинамики. Кинетика химических реакций
Элементы термодинамики. Кинетика химических реакций Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ)
Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ) Электролиз кезіндегі химиялық процестер
Электролиз кезіндегі химиялық процестер Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью
Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью Химия и производство
Химия и производство Вуглеводи
Вуглеводи Жасыл химия
Жасыл химия Колебания кристаллической решетки и ее тепловые свойства. Тепловые свойства
Колебания кристаллической решетки и ее тепловые свойства. Тепловые свойства Виды камней
Виды камней Теории химической кинетики. Лекция 4
Теории химической кинетики. Лекция 4 Роль хімії в природі
Роль хімії в природі Introduction to Biochemistry
Introduction to Biochemistry Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Рождение органической химии
Рождение органической химии Электрохимические системы
Электрохимические системы Адсорбция
Адсорбция Метаболизм жирных кислот
Метаболизм жирных кислот Соли аммония
Соли аммония Органічні сполуки: ліпіди
Органічні сполуки: ліпіди Металлы, их положение в ПСХЭ, физические и химические свойства
Металлы, их положение в ПСХЭ, физические и химические свойства Резина. Свойства резины
Резина. Свойства резины Строение и свойства циклоалканов
Строение и свойства циклоалканов Спирти. Хімічні властивості
Спирти. Хімічні властивості Вода - основа жизни
Вода - основа жизни Металлы. Общие свойства металлов
Металлы. Общие свойства металлов Общая характеристика неметаллов
Общая характеристика неметаллов