Содержание
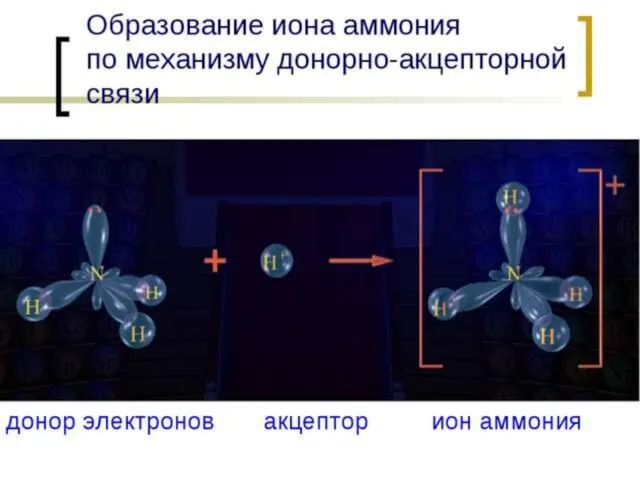
- 2. СОСТАВ солей аммония Соли аммония - это сложные вещества, в состав которых входят ионы аммония NH4+,
- 4. Физические свойства солей аммония Кристаллические вещества, хорошо растворимые в воде По строению, цвету и другим свойствам
- 5. Химические свойства солей аммония ОБЩИЕ С ДРУГИМИ СОЛЯМИ 1) Диссоциируют в водных растворах: NH4Cl ↔ NH4
- 6. Химические свойства солей аммония ОБЩИЕ С ДРУГИМИ СОЛЯМИ 3) Взаимодействуют с другими солями (реакция обмена): (NH4)2SO4
- 7. Химические свойства солей аммония СПЕЦИФИЧЕСКИЕ 1. При нагревании со щелочами выделяется аммиак (качественная реакция на ион
- 8. Химические свойства солей аммония СПЕЦИФИЧЕСКИЕ 2. Разлагаются при нагревании: a) если кислота летучая t NH4Cl →
- 9. Химические свойства солей аммония СПЕЦИФИЧЕСКИЕ 2. Разлагаются при нагревании: б) если анион проявляет окислительные свойства t
- 10. Получение солей аммония Получают взаимодействием NH3 или NH4OH с кислотами: NH3 + HNO3→NH4NO3 2NH4OH + H2SO4
- 11. Применение солей аммония Русский химик Д.Н Прянишников выяснил что растения предпочитают ионы аммония лучше нитратов Самое
- 12. Роль азотных соединений в жизни человека и общества велика, а применение разнообразно. Азот – основа жизни
- 13. Применение солей аммония Нитрат аммония NH4NО3 в смеси с порошками алюминия и угля используют в качестве
- 14. Применение солей аммония Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 применяют в кондитерском деле, так как
- 15. Применение солей аммония Хлорид аммония NH4Cl используют при паянии и лужении металлов, так как он очищает
- 16. Применение солей аммония Хлорид аммония применяется при изготовлении дымовых шашек.
- 17. Соли аммония Полезные, важные, Превращают пустыни в оазисы, Реагируют, как все соли, с солями, кислотами и
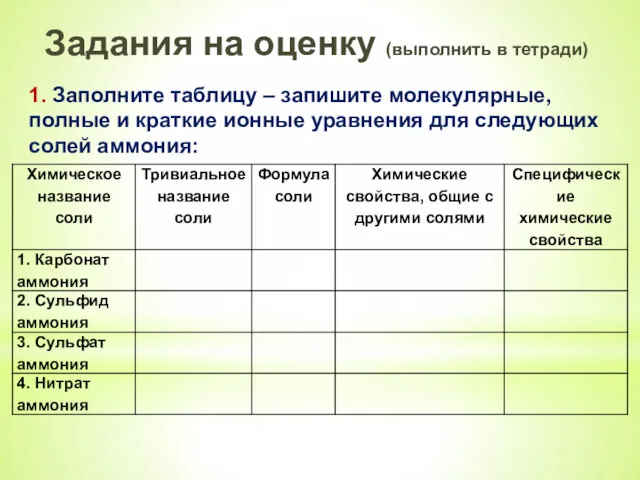
- 18. Задания на оценку (выполнить в тетради) 1. Заполните таблицу – запишите молекулярные, полные и краткие ионные
- 19. 2. Определите вещество (назовите его, приведя все возможные названия; напишите формулу). Напишите уравнения реакций в молекулярном
- 21. Скачать презентацию
















 Вода
Вода Строение атома
Строение атома Железо и его соединения
Железо и его соединения Особенности строения соединений органической химии. 10 класс
Особенности строения соединений органической химии. 10 класс Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів Основы химмотологии моторных топлив. Тема 3
Основы химмотологии моторных топлив. Тема 3 Prezentatciya
Prezentatciya Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Аналитическая химия стойких органических загрязнителей
Аналитическая химия стойких органических загрязнителей Получение каталитического слоя на основе углеродных нанотрубок с наночастицами платины для водородно–воздушных топливных элементов
Получение каталитического слоя на основе углеродных нанотрубок с наночастицами платины для водородно–воздушных топливных элементов Периодическая система химических элементов Д.И. Менделеева. Строение атома
Периодическая система химических элементов Д.И. Менделеева. Строение атома Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів
Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів Химический элемент. Изотопы. 11 класс
Химический элемент. Изотопы. 11 класс Непредельные углеводороды
Непредельные углеводороды Аминокислоты. Пептиды. Хроматографические методы исследования
Аминокислоты. Пептиды. Хроматографические методы исследования Воздух и его состав
Воздух и его состав Поверхностный мембранный потенциал. Равновесие Доннана
Поверхностный мембранный потенциал. Равновесие Доннана Трансмиссионные масла
Трансмиссионные масла Одноатомные спирты. Глицерин
Одноатомные спирты. Глицерин Неметаллические материалы
Неметаллические материалы Углеводы. Общая характеристика углеводов
Углеводы. Общая характеристика углеводов Полимеры органические и неорганические
Полимеры органические и неорганические Первоначальные представления об органических веществах
Первоначальные представления об органических веществах Металлы. Свойства металлов
Металлы. Свойства металлов Алканы. Получение, свойства и применение
Алканы. Получение, свойства и применение Общая характеристика металлов
Общая характеристика металлов Кислоты, их состав и названия
Кислоты, их состав и названия