Содержание
- 2. План I. Электрический заряд мембран II. Поверхностный потенциал мембран и его значение III. Метод флуоресцентных зондов
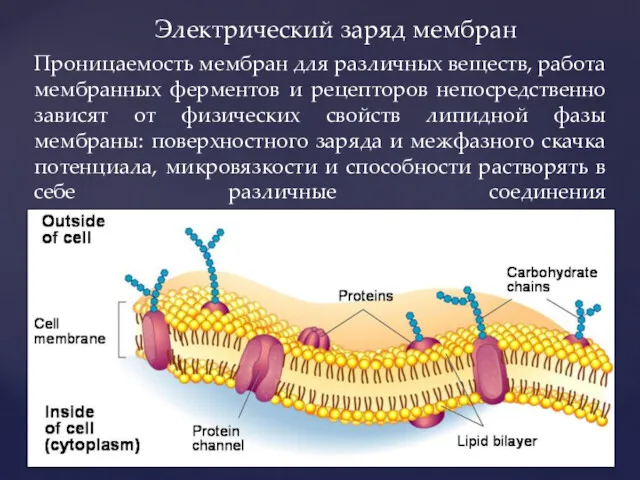
- 3. Проницаемость мембран для различных веществ, работа мембранных ферментов и рецепторов непосредственно зависят от физических свойств липидной
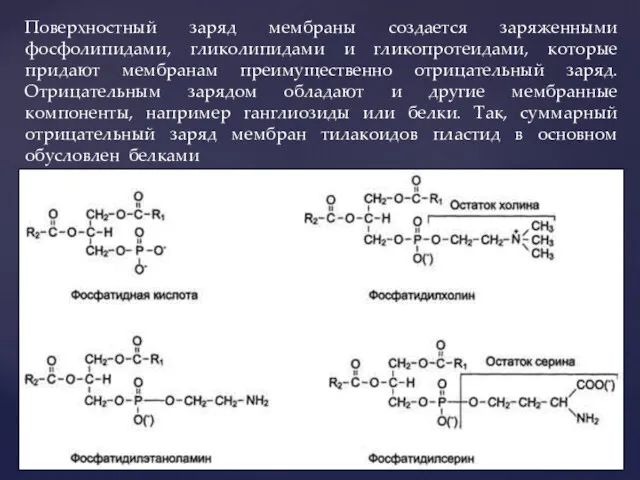
- 4. Поверхностный заряд мембраны создается заряженными фосфолипидами, гликолипидами и гликопротеидами, которые придают мембранам преимущественно отрицательный заряд. Отрицательным
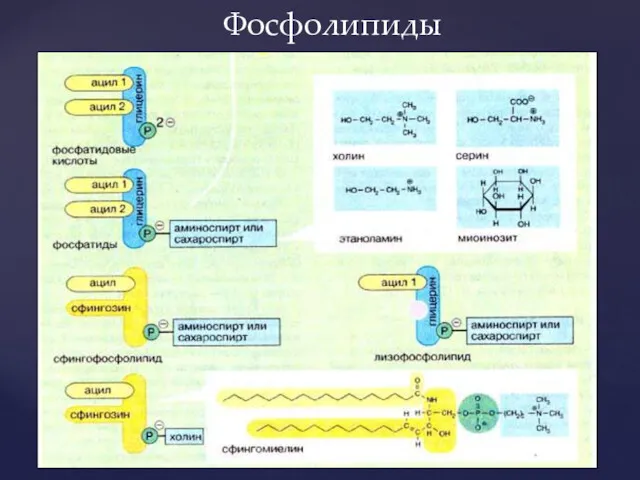
- 5. Фосфолипиды
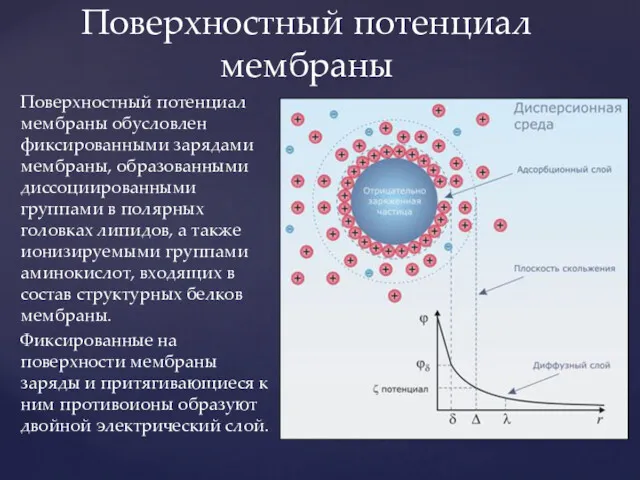
- 6. Поверхностный потенциал мембраны обусловлен фиксированными зарядами мембраны, образованными диссоциированными группами в полярных головках липидов, а также
- 7. Если поверхностная концентрация одновалентных заряженных групп равна σ кмоль/м2, то на границе мембрана – вода создается
- 8. Наличие заряда мембраны важно для стабильности мембранных структур (которые при нейтрализации зарядов начинают слипаться друг с
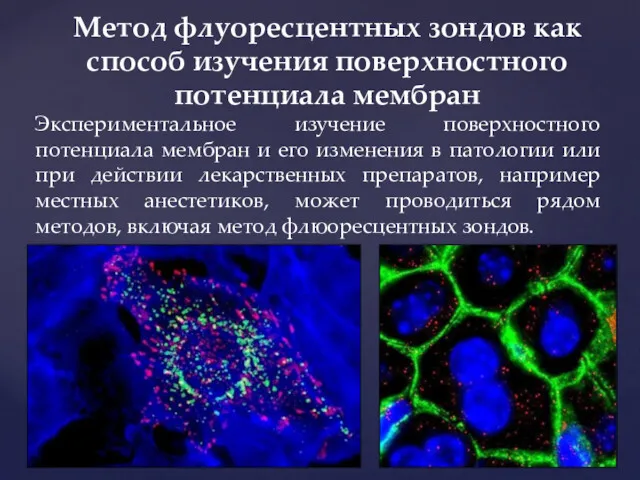
- 9. Экспериментальное изучение поверхностного потенциала мембран и его изменения в патологии или при действии лекарственных препаратов, например
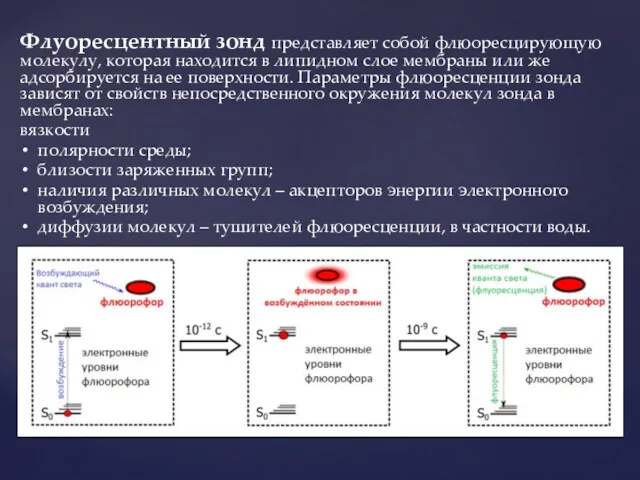
- 10. Флуоресцентный зонд представляет собой флюоресцирующую молекулу, которая находится в липидном слое мембраны или же адсорбируется на
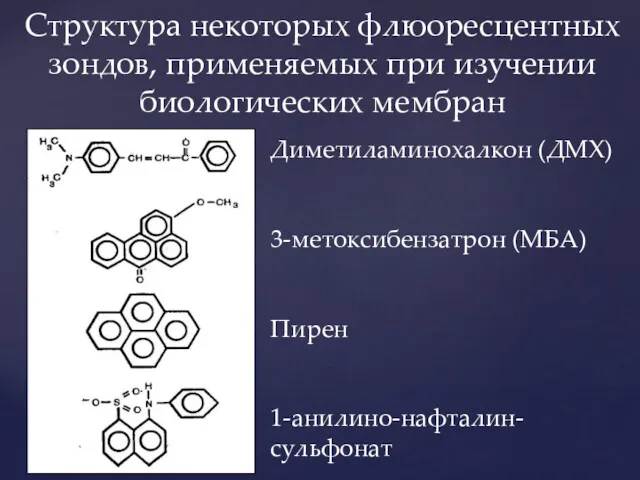
- 11. Структура некоторых флюоресцентных зондов, применяемых при изучении биологических мембран Диметиламинохалкон (ДМХ) 3-метоксибензатрон (МБА) Пирен 1-анилино-нафталин-сульфонат
- 12. Важной характеристикой мембраны является распределение зонда между мембраной и окружающей водной средой. Это распределение зависит от
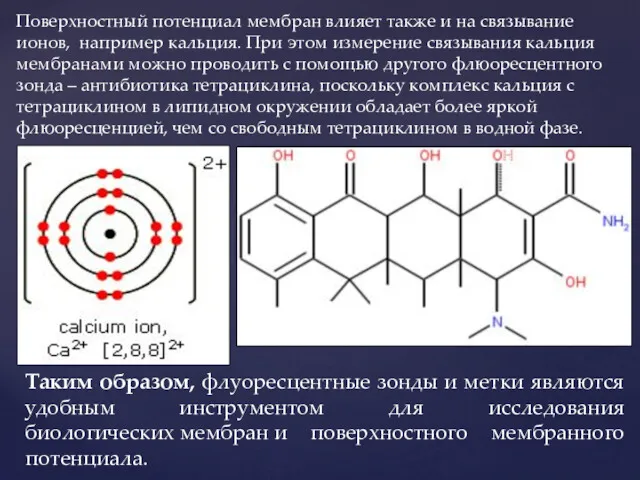
- 13. Поверхностный потенциал мембран влияет также и на связывание ионов, например кальция. При этом измерение связывания кальция
- 14. Мембранное равновесие (Доннана равновесие) – равновесие, устанавливающееся между двумя растворами, разделенными мембраной, непроницаемой хотя бы для
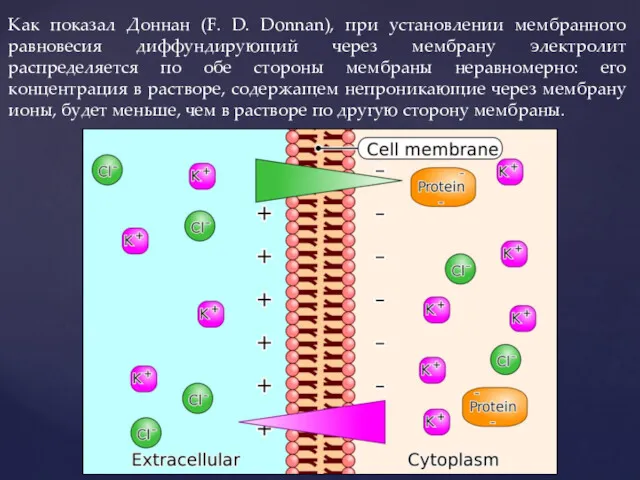
- 15. Как показал Доннан (F. D. Donnan), при установлении мембранного равновесия диффундирующий через мембрану электролит распределяется по
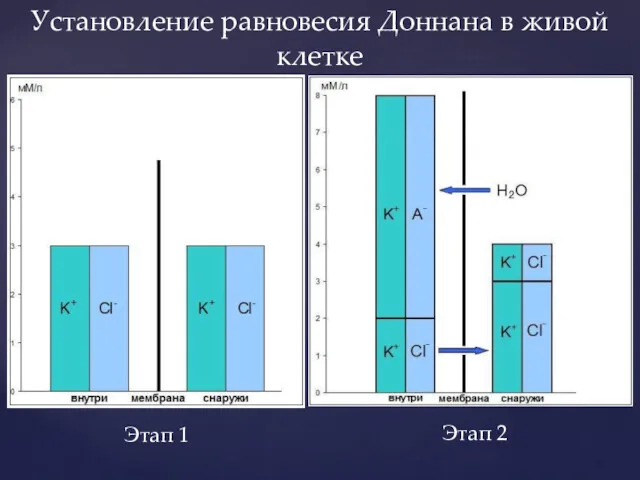
- 16. Установление равновесия Доннана в живой клетке Этап 1 Этап 2
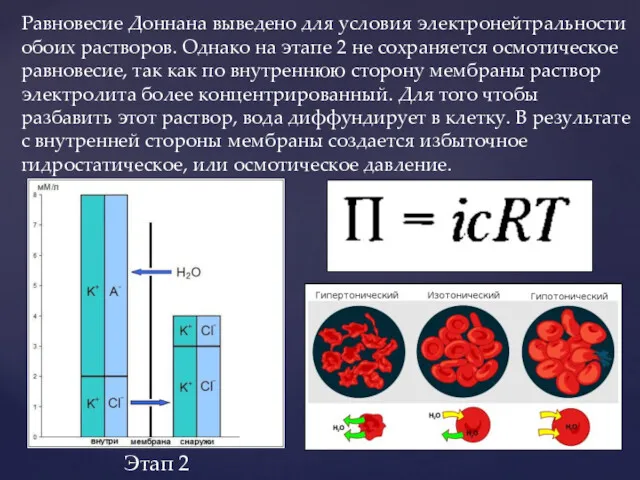
- 18. Равновесие Доннана выведено для условия электронейтральности обоих растворов. Однако на этапе 2 не сохраняется осмотическое равновесие,
- 19. В растительных клетках осмотическое давление несколько выше, чем в окружающей среде, но эти клетки не разрываются,
- 20. Значение Доннановского равновесия Все биологические мембраны полупроницаемы: в нормальных условиях проницаемы для неорганических солей и воды
- 21. Владимиров Ю. А. и др. Биофизика: Учебник. – М.: Медицина, 1983, 272 с. ил. Геннис Р.
- 23. Скачать презентацию









 Пластмаси та полімери
Пластмаси та полімери Властивості вуглеводів. Лабораторна робота 3
Властивості вуглеводів. Лабораторна робота 3 Химическая термодинамика. Экзаменационные вопросы
Химическая термодинамика. Экзаменационные вопросы Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений IVA группа С, Si, Ge, Sn, Pb (подгруппа титана)
IVA группа С, Si, Ge, Sn, Pb (подгруппа титана) Продукция UNIL
Продукция UNIL Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів
Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів Изотопная геохимия. U-Pb метод
Изотопная геохимия. U-Pb метод Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Альбитит-грейзеновые месторождения
Альбитит-грейзеновые месторождения Кислород. Общая характеристика и нахождение в природе. 8 класс
Кислород. Общая характеристика и нахождение в природе. 8 класс 20231228_himicheskiy_sostav_kletki_wecompress.com_
20231228_himicheskiy_sostav_kletki_wecompress.com_ Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар
Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар Спирты. Состав, строение спиртов
Спирты. Состав, строение спиртов Поширення солей у природі
Поширення солей у природі Цветные металлы и сплавы
Цветные металлы и сплавы Нефть и способы ее переработки. (10 класс)
Нефть и способы ее переработки. (10 класс) Хозяйственный механизм НГХК
Хозяйственный механизм НГХК Подкласс Иносиликаты (цепочечные/ленточные силикаты)
Подкласс Иносиликаты (цепочечные/ленточные силикаты) Обмен нуклеопротеинов
Обмен нуклеопротеинов Фосфор и его соединения
Фосфор и его соединения Кислоты
Кислоты Алкадиены. Непредельные углеводороды
Алкадиены. Непредельные углеводороды Водородная и донорно-акцепторная связи. (Лекция 15)
Водородная и донорно-акцепторная связи. (Лекция 15) Соединения железа
Соединения железа Химия элементов. Комплексные соединения: типы и классификация. Методы получения и разрушения
Химия элементов. Комплексные соединения: типы и классификация. Методы получения и разрушения Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки
Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки Гидролиз солей
Гидролиз солей