Химия элементов. Комплексные соединения: типы и классификация. Методы получения и разрушения презентация
Содержание
- 2. Типы комплексных соединений. 1. Аквакомплексы В водных растворах: [Be(H2O)4]2+ [Al(H2O)6]3+ [Cr(H2O)6]3+ … Кристаллогидраты: [Be(H2O)4]SO4 [Al(H2O)6]Cl3 [K(H2O)6][Cr(H2O)6](SO4)2
- 3. Термич. разложение: CuSO4·5H2O ⭣ CuSO4·4H2O + H2O(г) ⭣ CuSO4 + 4H2O(г) [Cu(H2O)4]SO4·H2O («медный купорос»)
- 4. [Fe(H2O)6]SO4·H2O («железный купорос»)
- 5. 2. Гидроксокомплексы Получение: Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH >> 7 Разрушение: [Zn(OH)4]2– (+H3O+) ⭣ +
- 6. 3. Аммины (аммиакаты) Получение: AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl– + 2H2O Разрушение: [Ag(NH3)2]+ + H3O+
- 7. Получение: HgI2(т) + 2I–(изб.) = [HgI4]2– [Fe(H2O)6]3+ + 6NCS−=[Fe(NCS)6]3− + 6H2O Разрушение: [HgI4]2– + S2– =
- 8. Получение: 4 NaH + B(OCH3)3 = Na[BH4] + 3CH3ONa (при 250 °C) 4 LiH + AlCl3
- 9. 6. Анионгалогенаты M[ЭГ′mГ″n] (Э, Г′ и Г″ – галогены) Получение: KI + I2 = K[I(I)2]; CsCl
- 10. Получение: Ni(т) + 4CO(г) = [Ni(CO)4](ж) (ниже 50 °С) тетракарбонилникель(0) Разрушение: [Ni(CO)4](ж) + t° = Ni(т)
- 11. Правило Сиджвика для определения состава комплексов Устойчивым является комплекс, в котором реализована 18-электронная оболочка из s-,
- 12. Правило Сиджвика (примеры) * 27Co0 [Ar]3d74s2 || 36Kr * 18 – 9 = 9e –; *
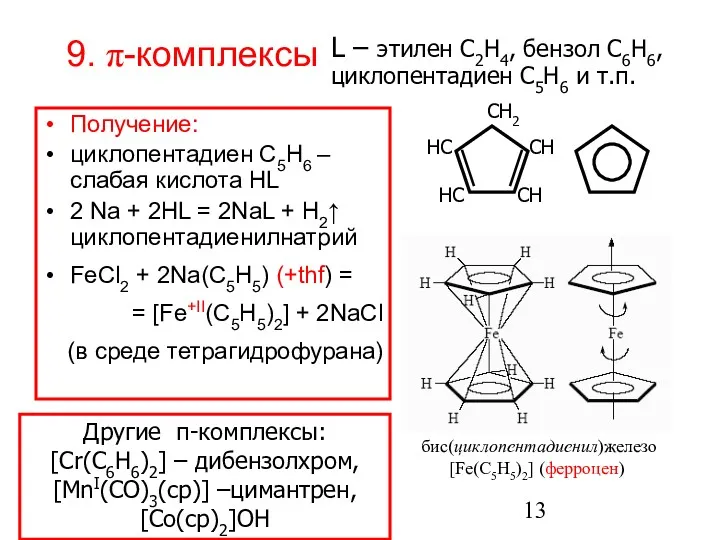
- 13. 9. π-комплексы Получение: циклопентадиен С5H6 – слабая кислота HL 2 Na + 2HL = 2NaL +
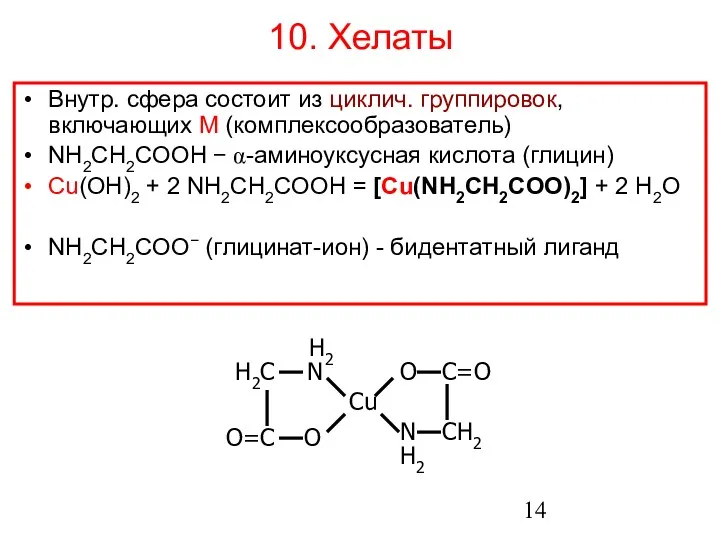
- 14. 10. Хелаты Внутр. сфера состоит из циклич. группировок, включающих M (комплексообразователь) NH2CH2COOH − α-аминоуксусная кислота (глицин)
- 15. Реакция Чугаева Ni2+ + 2 NH3·H2O + 2H2L = = [Ni(HL)2](т) + 2NH4+ + 2H2O бис(диметилглиоксимато)никель
- 16. Методы синтеза комплексных соединений Реакция обмена лигандов А) в водном растворе (βобр, принцип Ле Шателье): [Сu(H2O)4]2+
- 17. Д) ОВР + реакции обмена лигандов +Ок.+ L [СoII(H2O)6]2+ → [СoIIIL6]3+ Ок.: H2O2, KNO2 … L
- 18. Растворение осадка при комплексообразовании AgBr(т) ⮀ Ag+ + Br – ; ПРAgBr = 7,7·10–13 Ag+ +
- 19. Реакция обмена лигандов [Co(NH3)6]3+ + 6 CN– ⮀ [Co(CN)6]3– + 6 NH3; Kc = ? Co3+
- 20. Разрушение комплекса [Cu(NH3)4]2+ + 4 H3O+ ⮀ [Cu(H2O)4]2+ + 4 NH4+ ; Kc = ? Cu2+
- 22. Скачать презентацию
![Типы комплексных соединений. 1. Аквакомплексы В водных растворах: [Be(H2O)4]2+ [Al(H2O)6]3+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/287448/slide-1.jpg)
![Термич. разложение: CuSO4·5H2O ⭣ CuSO4·4H2O + H2O(г) ⭣ CuSO4 + 4H2O(г) [Cu(H2O)4]SO4·H2O («медный купорос»)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/287448/slide-2.jpg)
![[Fe(H2O)6]SO4·H2O («железный купорос»)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/287448/slide-3.jpg)
![2. Гидроксокомплексы Получение: Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH >>](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/287448/slide-4.jpg)
![3. Аммины (аммиакаты) Получение: AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/287448/slide-5.jpg)
![Получение: HgI2(т) + 2I–(изб.) = [HgI4]2– [Fe(H2O)6]3+ + 6NCS−=[Fe(NCS)6]3− +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/287448/slide-6.jpg)
![Получение: 4 NaH + B(OCH3)3 = Na[BH4] + 3CH3ONa (при](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/287448/slide-7.jpg)
![6. Анионгалогенаты M[ЭГ′mГ″n] (Э, Г′ и Г″ – галогены) Получение:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/287448/slide-8.jpg)
 (ниже 50 °С) тетракарбонилникель(0)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/287448/slide-9.jpg)

![Правило Сиджвика (примеры) * 27Co0 [Ar]3d74s2 || 36Kr * 18](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/287448/slide-11.jpg)
 + 2NH4+ + 2H2O бис(диметилглиоксимато)никель](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/287448/slide-14.jpg)

![Д) ОВР + реакции обмена лигандов +Ок.+ L [СoII(H2O)6]2+ →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/287448/slide-16.jpg)

![Реакция обмена лигандов [Co(NH3)6]3+ + 6 CN– ⮀ [Co(CN)6]3– +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/287448/slide-18.jpg)
![Разрушение комплекса [Cu(NH3)4]2+ + 4 H3O+ ⮀ [Cu(H2O)4]2+ + 4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/287448/slide-19.jpg)
 Жидкокристаллические индикаторы
Жидкокристаллические индикаторы Элементы VА-группы
Элементы VА-группы Периодический закон Д. И. Менделеева
Периодический закон Д. И. Менделеева Кислоты 8 класс
Кислоты 8 класс Спектрофометрия
Спектрофометрия Понятия и определения химической термодинамики. (Лекция 11)
Понятия и определения химической термодинамики. (Лекция 11) Химия и сельское хозяйство
Химия и сельское хозяйство Каталитический риформинг
Каталитический риформинг История открытия периодической системы химических элементов Д.И. Менделеева
История открытия периодической системы химических элементов Д.И. Менделеева Химия и путешествия во времени. Задача 7
Химия и путешествия во времени. Задача 7 Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ
Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ Электронные конфигурации атомов
Электронные конфигурации атомов Минералогия литофильных редких элементов. Бор
Минералогия литофильных редких элементов. Бор Биологически важные пяти- и шестичленные гетероциклы с одним и двумя гетероатомами
Биологически важные пяти- и шестичленные гетероциклы с одним и двумя гетероатомами Загрязнители пищи тяжелые металлы, радиоктивные элементы, ПАУ, пестициды, и нитрозамины
Загрязнители пищи тяжелые металлы, радиоктивные элементы, ПАУ, пестициды, и нитрозамины Общие черты гидротермальных месторождений
Общие черты гидротермальных месторождений Химическая связь
Химическая связь Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде
Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие
Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие Органолептические и визуальные методы идентификация полимера
Органолептические и визуальные методы идентификация полимера Углекислый газ
Углекислый газ Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1 Физические свойства минералов
Физические свойства минералов Классификация химических реакций
Классификация химических реакций Вода-растворитель. Работа воды в природе
Вода-растворитель. Работа воды в природе Классификация и номенклатура основных классов неорганических соединений
Классификация и номенклатура основных классов неорганических соединений Атомы и молекулы. Простые и сложные вещества. 8 класс
Атомы и молекулы. Простые и сложные вещества. 8 класс