Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ презентация
Содержание
- 3. Нахождение халькогенов в природе Кислорода в земной коре примерно 47,4% (1-е место по распространению в земной
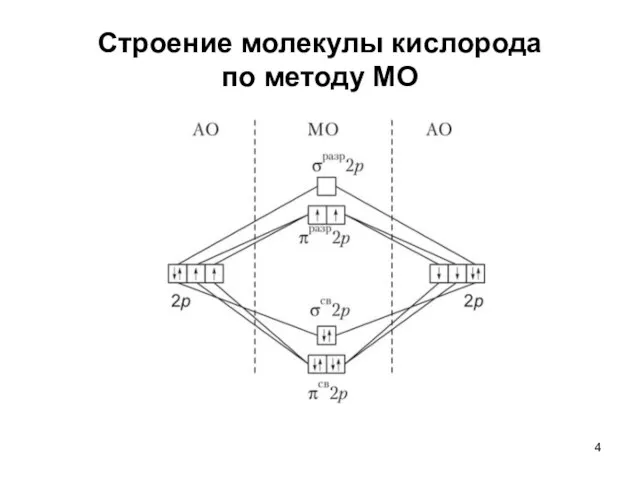
- 4. Строение молекулы кислорода по методу МО
- 5. Строение молекулы кислорода по методу МО Величина парамагнетизма молекулы кислорода отвечает наличию двух непарных электронов: КК
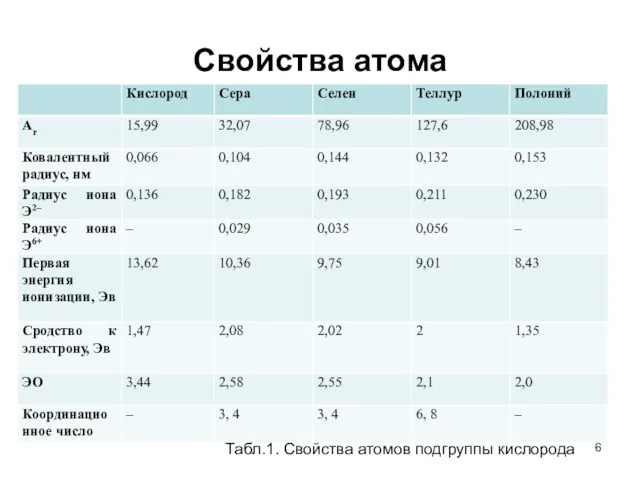
- 6. Свойства атома Табл.1. Свойства атомов подгруппы кислорода
- 7. Изотопы кислорода Кислород – 3 стабильных изотопа: 16О (99,759%), 17О (0,037%) и 18О (0,204%). Искусственно получены
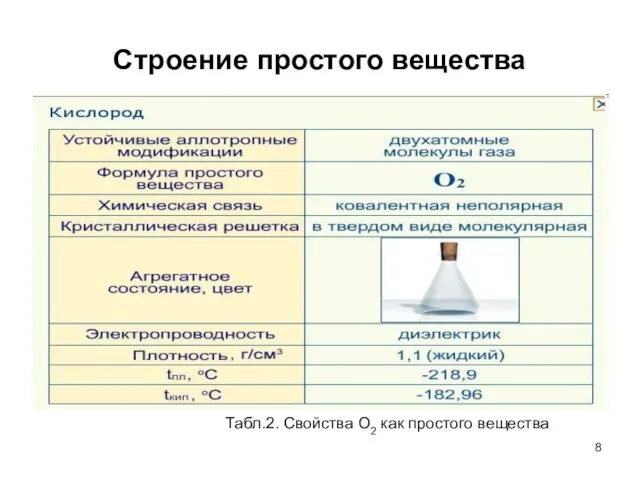
- 8. Строение простого вещества Табл.2. Свойства О2 как простого вещества
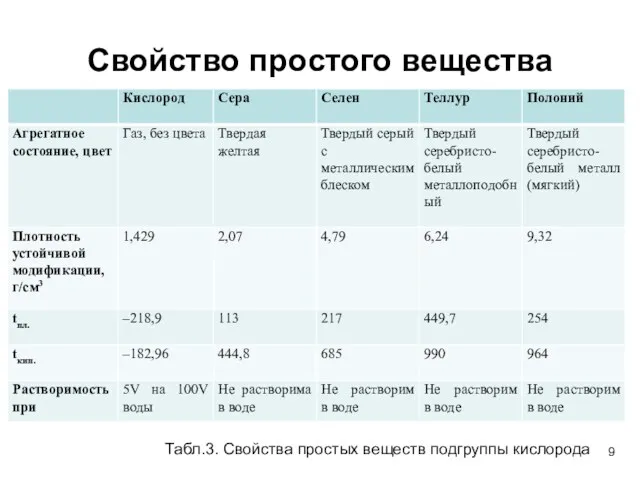
- 9. Свойство простого вещества Табл.3. Свойства простых веществ подгруппы кислорода
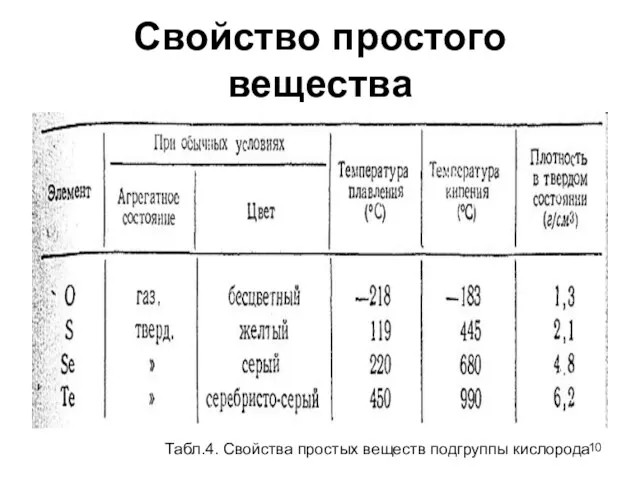
- 10. Свойство простого вещества Табл.4. Свойства простых веществ подгруппы кислорода
- 11. Получение кислорода Промышленные способы получения из атмосферного воздуха Кислород получают ректификацией жидкого воздуха. tкип(О2) = –183оС;
- 12. Лабораторные способы получения кислорода Термическое разложении богатых кислородом веществ: 2KMnO4 t K2MnO4 + MnO2 + O2
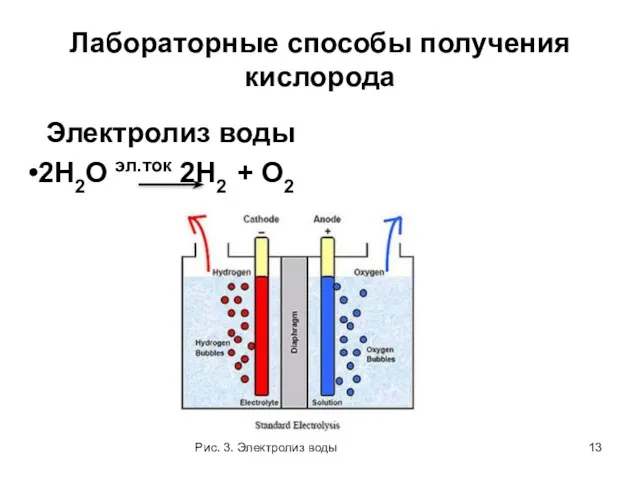
- 13. Лабораторные способы получения кислорода Электролиз воды 2H2O эл.ток 2H2 + O2 Рис. 3. Электролиз воды
- 14. Химические свойства простых веществ Окислительные свойства простых веществ 1) Реакции с простыми веществами: а) O2 с
- 15. Химические свойства простых веществ Окислительные свойства простых веществ 1) Реакции с простыми веществами: а) O3 с
- 16. Окислительные свойства простых веществ б) с металлами (кислород с литием, натрием, калием, железом, сера с железом,
- 17. Окислительные свойства простых веществ 2) Реакции со сложными веществами 2Fe(OH)2 + O2 → 2FeO(OH)2↓ 4Fe +
- 18. Окислительные свойства простых веществ 2) Реакции со сложными веществами 4О3 + 4КОН → 4КО3 + О2
- 19. Окислительные свойства простых веществ В газовой фазе озон взаимодействует с сероводородом с образованием диоксида серы: H2S
- 20. Восстановительные свойства кислорода
- 21. Жидкий кислород Рис.3. Жидкий кислород. Хранение
- 22. Озон Озон (от греч. «озо» пахнуть) – синий газ с резким запахом, жидкий озон – темно-синий,
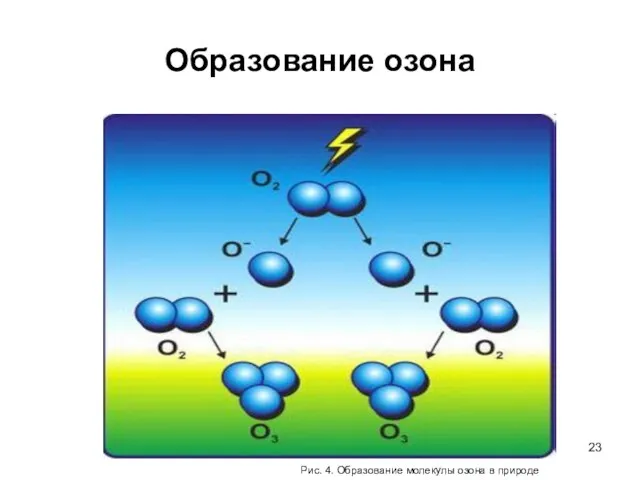
- 23. Образование озона Рис. 4. Образование молекулы озона в природе
- 24. Образование молекулы озона Центральный атом связан с крайними атомами двумя ковалентными связями. Дополнительно образуется трёхцентровая связь,
- 26. Фотохимия озона Для видимого света и для излучения в ближней ультрафиолетовой области кислород практически прозрачен, однако
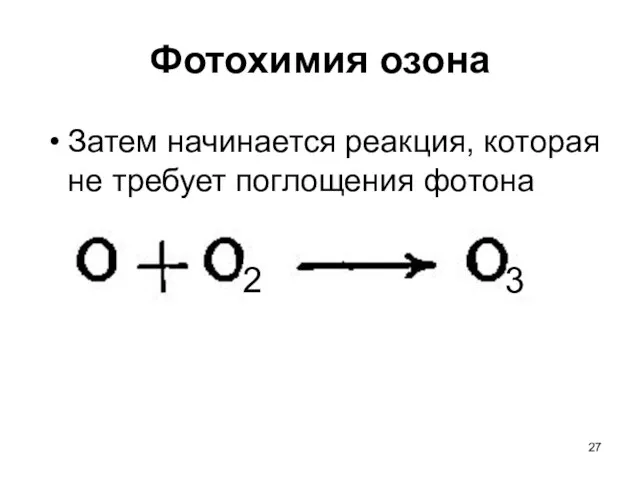
- 27. Фотохимия озона Затем начинается реакция, которая не требует поглощения фотона 2 3
- 28. Фотохимия озона Таким образом, в результате поглощения одного фотона образуются две молекулы озона Оз. Вместе с
- 29. Разрушение озонового слоя Рис. 5. Круговорот озона в природе
- 30. Разрушение озонового слоя Геофизическое и биологическое значение озонового слоя определяется тем, что озон поглощает излучение в
- 32. Скачать презентацию





















 Химические свойства металлов
Химические свойства металлов Золото. Что о нём мы можем рассказать?
Золото. Что о нём мы можем рассказать? d-элементы
d-элементы Подготовка к ВПР по химии. 11 класс
Подготовка к ВПР по химии. 11 класс Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия Кислотные дожди
Кислотные дожди The Molecules of Life
The Molecules of Life Цинк и его соединения
Цинк и его соединения Фосфор и его соединения
Фосфор и его соединения Химия воды
Химия воды Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Классификация химических элементов
Классификация химических элементов Способы выражения состава раствора. Задача 7
Способы выражения состава раствора. Задача 7 НЮ 2.1.1. Металлы - общая характеристика
НЮ 2.1.1. Металлы - общая характеристика Гониометрическое исследование кристаллов
Гониометрическое исследование кристаллов Сплавы железа с углеродом: стали и чугуны
Сплавы железа с углеродом: стали и чугуны Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування
Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування Мінерали та гірські породи
Мінерали та гірські породи Серная кислота
Серная кислота Electrolysis
Electrolysis Вещества
Вещества Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Аминокислоты 2
Аминокислоты 2 Метаболизм углеводов
Метаболизм углеводов Спектральные методы: атомная спектроскопия
Спектральные методы: атомная спектроскопия Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості