Содержание
- 2. Важно! № группы = количеству электронов на внешнем уровне № периода = количеству электронных уровней от
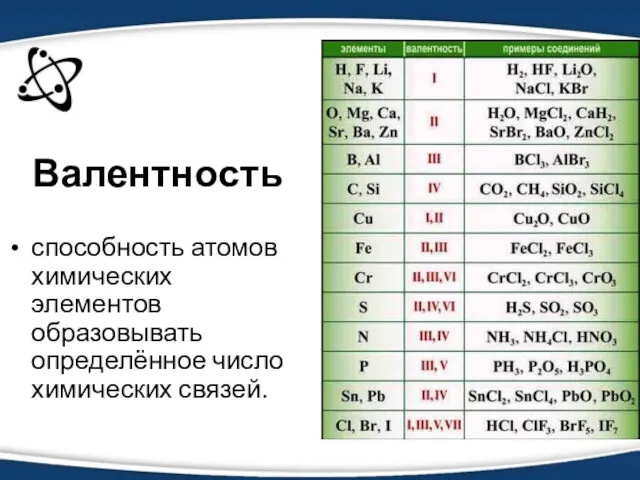
- 3. Валентность способность атомов химических элементов образовывать определённое число химических связей.
- 4. Степень окисления Валентность
- 5. Электроотрицательность это способность атомов притягивать электроны при связывании с другими атомами. Окислитель – забирает электроны («окислитель–
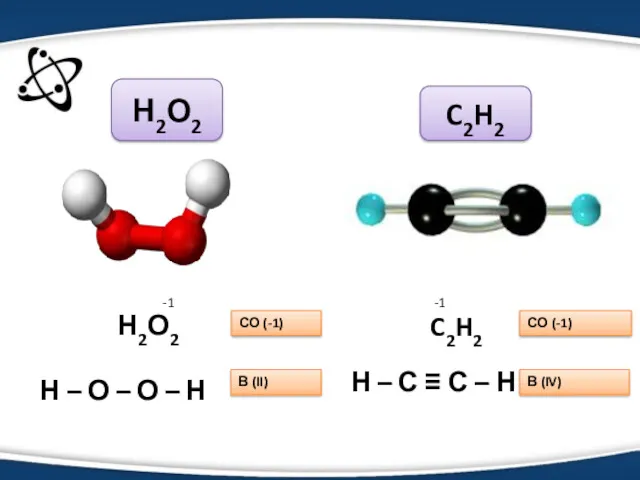
- 6. Н2О2 Н – О – О – Н СО (-1) В (II) C2H2 СО (-1) Н
- 7. Степень окисления – это условный заряд атомов химического элемента в соединении, если предположить, что оно состоит
- 8. Минимальная степень окисления = № группы – 8, у N (-3) Максимальная степень окисления равна номеру
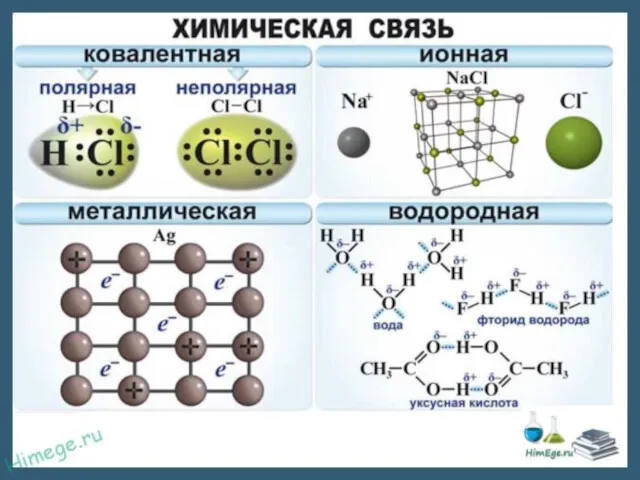
- 9. Образуется между ионами – заряженными частицами; Образуется между элементами, Электроотрицательность которых сильно отличается друг от друга;
- 10. Ковалентная неполярная связь Образуется между элементами неметаллами с одинаковой Электроотрицательность за счет объединения неспаренных электронных пар
- 11. Ковалентная полярная связь Образуется между элементами неметаллами, Электроотрицательность которых незначительно отличается друг о друга. Между неметаллами
- 12. Образуется между атомами и ионами металлов. Существует в простых веществах металлах, а также в их сплавах.
- 13. Образуется между водородом и более электроотрицательным элементом. Чаще всего это кислород, азот, сера. Связь непрочная, но
- 16. Скачать презентацию










 Азотсодержащие органические соединения. Аминокислоты (часть 2)
Азотсодержащие органические соединения. Аминокислоты (часть 2) Липиды. Классификация липидов
Липиды. Классификация липидов Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов
Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов Кристаллическое строение и кристаллизация металлов
Кристаллическое строение и кристаллизация металлов Аурум
Аурум Естери. Класифікація та номенклатура естерів
Естери. Класифікація та номенклатура естерів Сравнение нормативов некоторых веществ
Сравнение нормативов некоторых веществ Строение атома
Строение атома Методы разделения белковых смесей. Электрофорез
Методы разделения белковых смесей. Электрофорез Кислоты, их состав и названия
Кислоты, их состав и названия Ненасыщенные (непредельные) алифатические углеводороды. Алкены
Ненасыщенные (непредельные) алифатические углеводороды. Алкены Строение атома. Периодический закон Д. И. Менделеева
Строение атома. Периодический закон Д. И. Менделеева Химическая связь и ее типы. Кристаллические решетки
Химическая связь и ее типы. Кристаллические решетки Теория электролитической диссоциации. Кислотно-основные равновесия в водных растворах
Теория электролитической диссоциации. Кислотно-основные равновесия в водных растворах Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Фенол и его свойства
Фенол и его свойства Проект на тему Екзо- та ендотермічні реакції на службі людства
Проект на тему Екзо- та ендотермічні реакції на службі людства Частицы вещества: молекула, атом, ион
Частицы вещества: молекула, атом, ион Оксид серы (IV). Сернистая кислота и её соли
Оксид серы (IV). Сернистая кислота и её соли Физические и химические явления. Признаки химических реакций
Физические и химические явления. Признаки химических реакций Некоторые закономерности протекания химических реакций: тепловой эффект реакции, скорость реакции, химическое равновесие
Некоторые закономерности протекания химических реакций: тепловой эффект реакции, скорость реакции, химическое равновесие Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Хроматографические методы в аналитической химии
Хроматографические методы в аналитической химии Мінеральні добрива
Мінеральні добрива Электролиз. 11 класс
Электролиз. 11 класс Щелочные металлы
Щелочные металлы Периодическая система элементов, предсказание химических свойств элементов на основе таблицы
Периодическая система элементов, предсказание химических свойств элементов на основе таблицы Углекислый газ
Углекислый газ