Содержание
- 2. Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы
- 3. Как атомы соединяются в молекулы?
- 4. Электроотрицательность (ЭО) – Значение электроотрицательности химических элементов второго периода (по шкале Полинга) это способность атомов элемента
- 5. Значение электроотрицательности химических элементов первой группы главной подгруппы
- 6. Как изменяется электроотрицательность в таблице химических элементов? ЭО увеличивается уменьшается
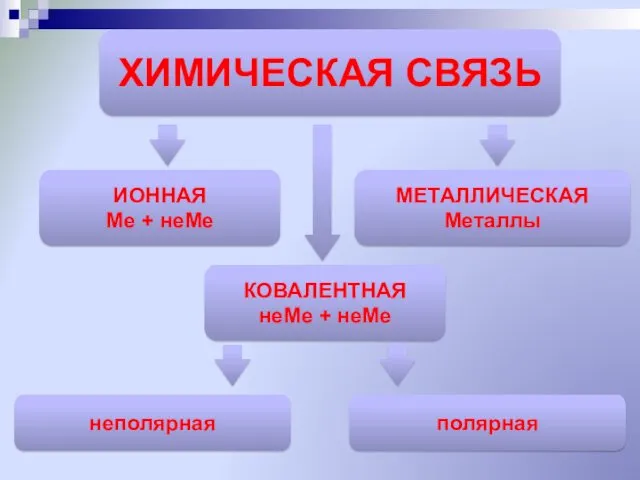
- 7. ХИМИЧЕСКАЯ СВЯЗЬ КОВАЛЕНТНАЯ неМе + неМе ИОННАЯ Ме + неМе МЕТАЛЛИЧЕСКАЯ Металлы неполярная полярная
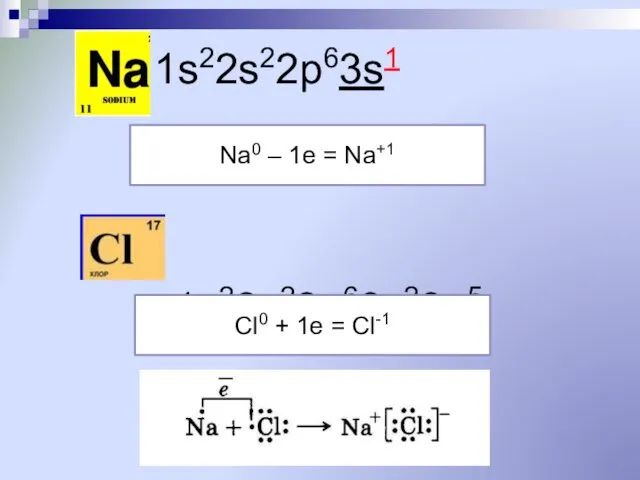
- 8. Ионная химическая связь это связь, образовавшаяся за счет электростатического притяжения ионов. Образуется между атомами с различной
- 9. 1s22s22p63s1 1s22s22p63s23p5 Na0 – 1e = Na+1 Cl0 + 1e = Cl-1
- 10. Ионы: катионы (+); анионы (-) Для катионов: энергия ионизации – свойство терять свои валентные электроны Для
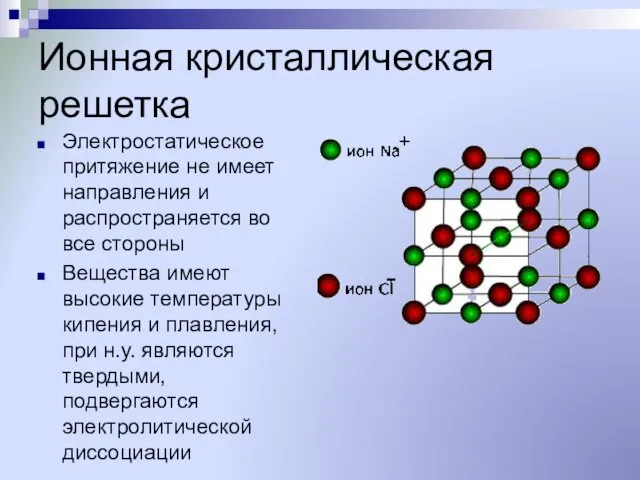
- 11. Ионная кристаллическая решетка Электростатическое притяжение не имеет направления и распространяется во все стороны Вещества имеют высокие
- 12. Металлическая связь связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в
- 13. Металлическая кристаллическая решетка Связь осуществляется между всеми атомами кристалла Вещества пластичные, высоко электро-, теплопроводные, блестящие, непрозрачные,
- 14. Ковалентная химическая связь это связь, возникающая между атомами за счет образования общих электронных пар Обменный Механизм
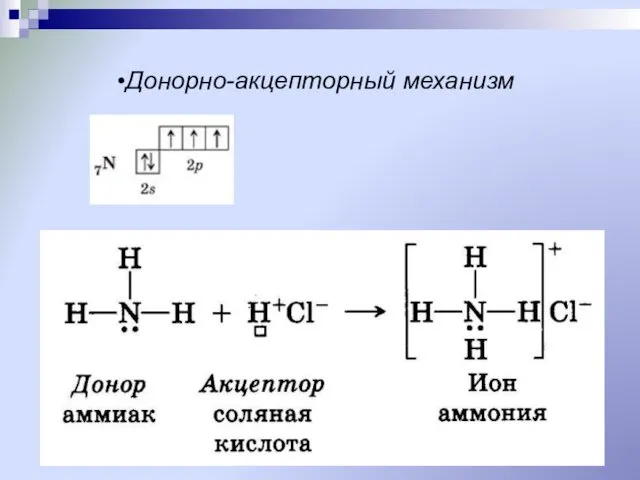
- 16. Донорно-акцепторный механизм
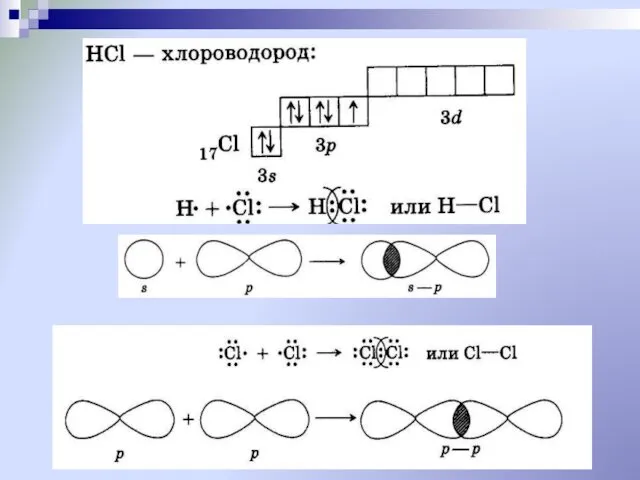
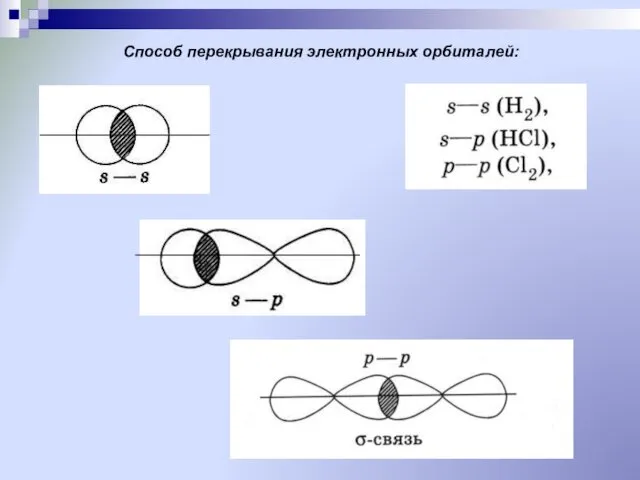
- 17. Способ перекрывания электронных орбиталей:
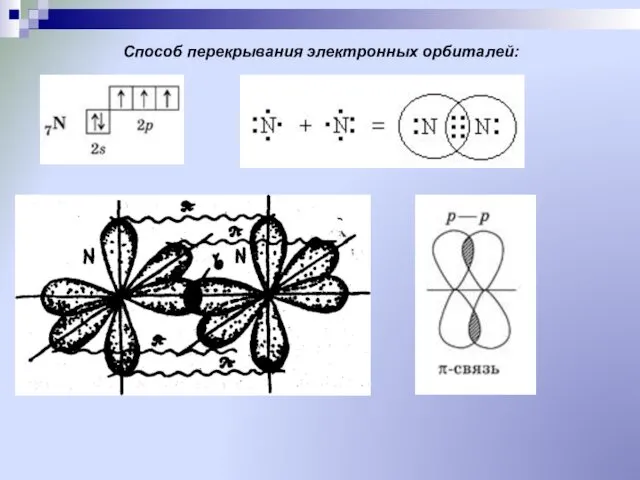
- 18. Способ перекрывания электронных орбиталей:
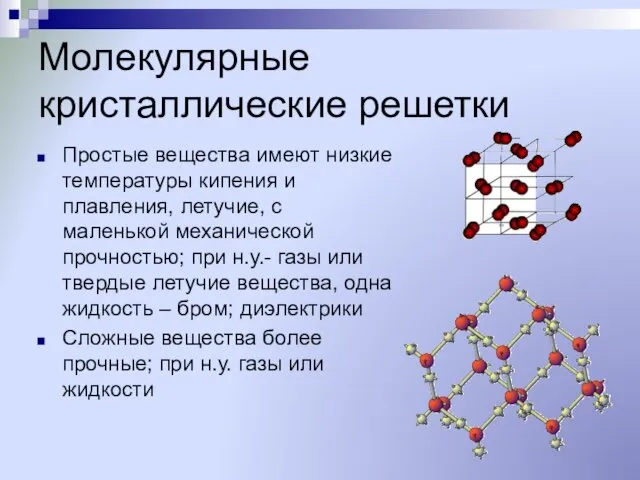
- 19. Молекулярные кристаллические решетки Простые вещества имеют низкие температуры кипения и плавления, летучие, с маленькой механической прочностью;
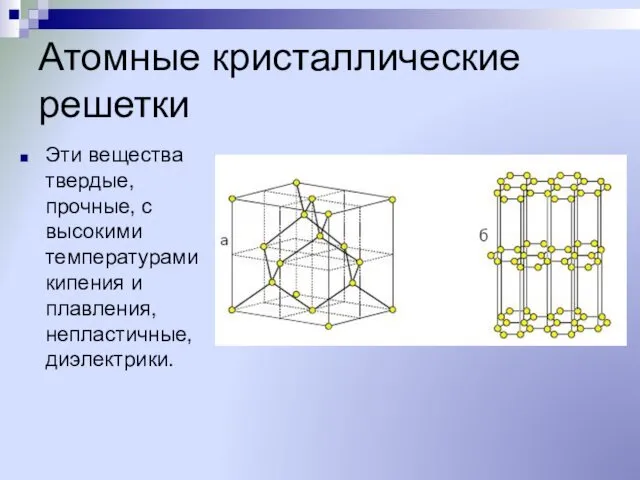
- 20. Атомные кристаллические решетки Эти вещества твердые, прочные, с высокими температурами кипения и плавления, непластичные, диэлектрики.
- 21. Задание: определить агрегатное состояние веществ Частицы вещества не связаны друг с другом, способны свободно перемещаться. Очень
- 22. Задание: Составьте сводную таблицу, в которой необходимо соотнести все виды агрегатных состояний, типы кристаллических решеток и
- 23. СВОЙСТВА КОВАЛЕНТНОЙ СВЯЗИ
- 24. 1. Кратность ковалентной связи число общих электронных пар, связывающих атомы CO2 оксид углерода (IV) о=с=о N2
- 25. 2. Полярность ковалентной связи степень смещенности общих электронных пар к одному из связанных ими атомов Ковалентную
- 26. ЭО(Н) σ+ σ-
- 27. 3. Длина Межъядерное расстояние, обозначатся ג , измеряется в нм. Чем больше длина связи, тем она
- 28. 4. Энергия связи Энергия, необходимая для разрыва связи. В 1 моль вещества энергия связи измеряется в
- 29. 5. Насыщенность способность химического элемента образовывать определенное число связей У водорода – 1 связь; у кислорода
- 30. 6. Направленность определяет геометрию молекул и зависит от: формы орбиталей
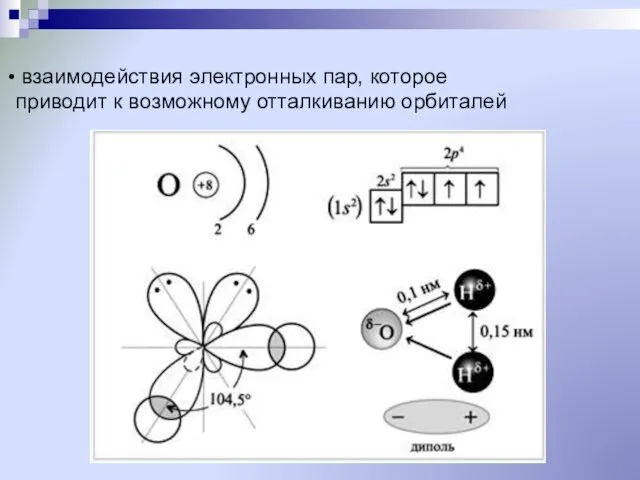
- 31. взаимодействия электронных пар, которое приводит к возможному отталкиванию орбиталей
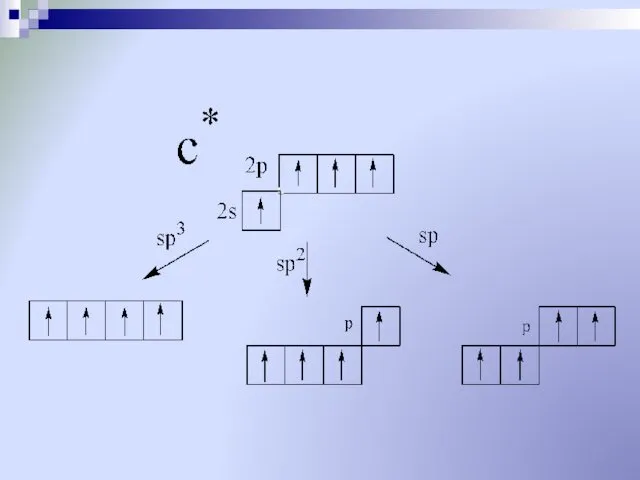
- 32. от образования гибридных орбиталей нормальное состояние
- 33. возбужденное состояние *
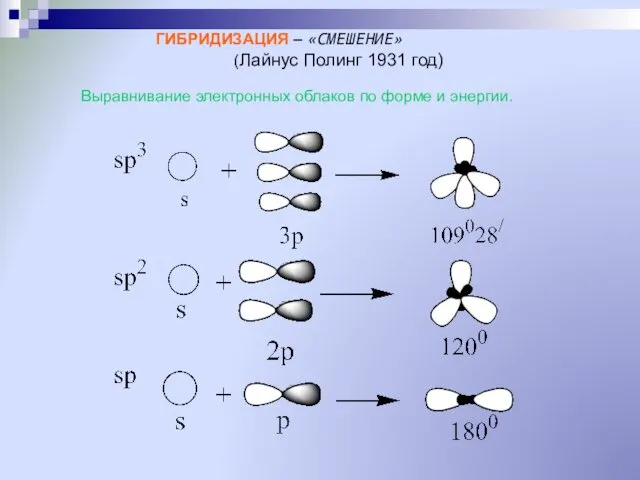
- 35. ГИБРИДИЗАЦИЯ – «СМЕШЕНИЕ» (Лайнус Полинг 1931 год) Выравнивание электронных облаков по форме и энергии.
- 36. Водородная связь возникает в соединениях, где водород связан с атомами, имеющими высокую электроотрицательность (О, N, F)
- 38. Скачать презентацию















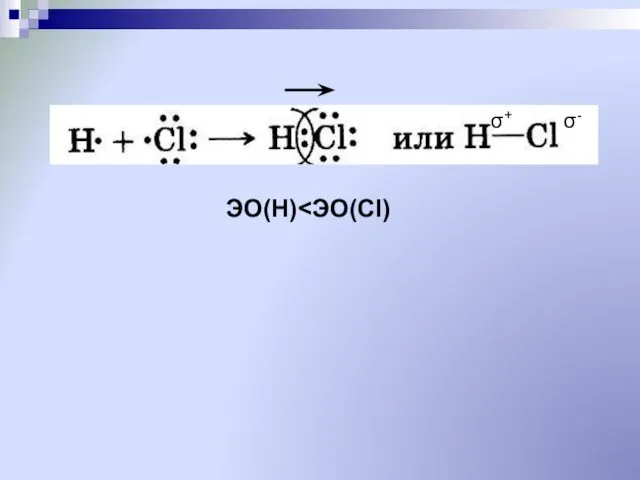







 топ през
топ през Благородные металлы
Благородные металлы Полимеры, бумага
Полимеры, бумага Анализ раствора кальция хлорида 5%-200 мл
Анализ раствора кальция хлорида 5%-200 мл Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Магний и кальций
Магний и кальций Вода. 8 класс
Вода. 8 класс Гидролиз солей. Лекция №9
Гидролиз солей. Лекция №9 Кислородные соединения серы. 2 часть
Кислородные соединения серы. 2 часть Переходные элементы
Переходные элементы Деструктивные процессы переработки нефти
Деструктивные процессы переработки нефти Складання рівнянь окисно-відновних реакцій. Метод електронного балансу
Складання рівнянь окисно-відновних реакцій. Метод електронного балансу Законы химии
Законы химии Plastic is one of the challenges of the 21st century
Plastic is one of the challenges of the 21st century Методы определения механических свойств полимерных композиционных материалов
Методы определения механических свойств полимерных композиционных материалов Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение Энергетика химических процессов. Термодинамика. (Лекция 4)
Энергетика химических процессов. Термодинамика. (Лекция 4) Циклоалканы. 10 класс
Циклоалканы. 10 класс Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік
Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік Сера и ее соединения
Сера и ее соединения Термохимия. Расчет тепловых эффектов химических реакций
Термохимия. Расчет тепловых эффектов химических реакций Реакции SR в ряду алканов
Реакции SR в ряду алканов Классификация химических реакций. 8 класс
Классификация химических реакций. 8 класс Спирты, фенолы, тиолы
Спирты, фенолы, тиолы Оксиды. 8 класс
Оксиды. 8 класс Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Природный и попутный нефтяной газы
Природный и попутный нефтяной газы Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение)