Содержание
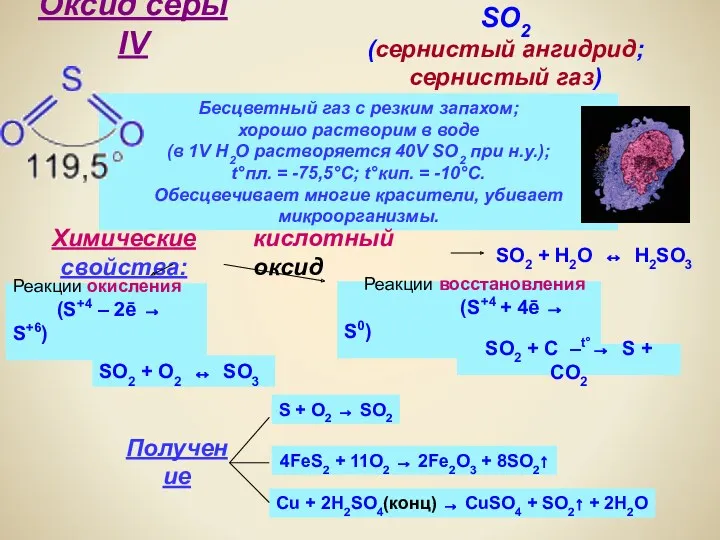
- 2. Оксид серы IV SO2 (сернистый ангидрид; сернистый газ) Бесцветный газ с резким запахом; хорошо растворим в
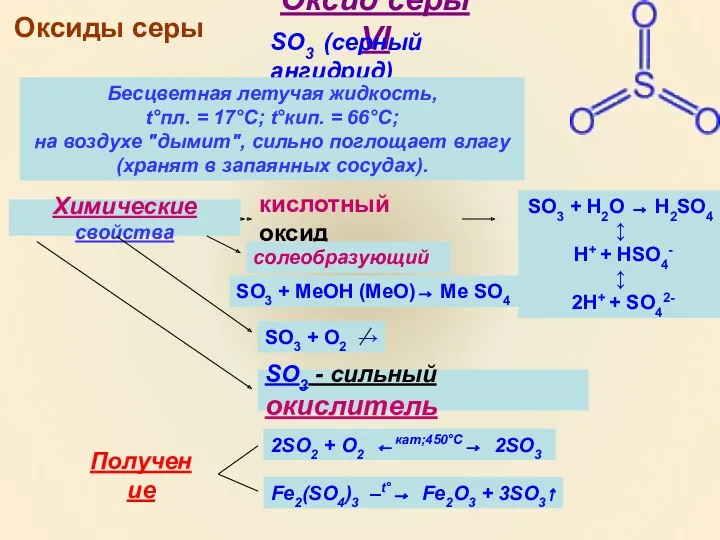
- 3. Оксиды серы Оксид серы VI SO3 (серный ангидрид) Бесцветная летучая жидкость, t°пл. = 17°C; t°кип. =
- 5. Получение оксидов
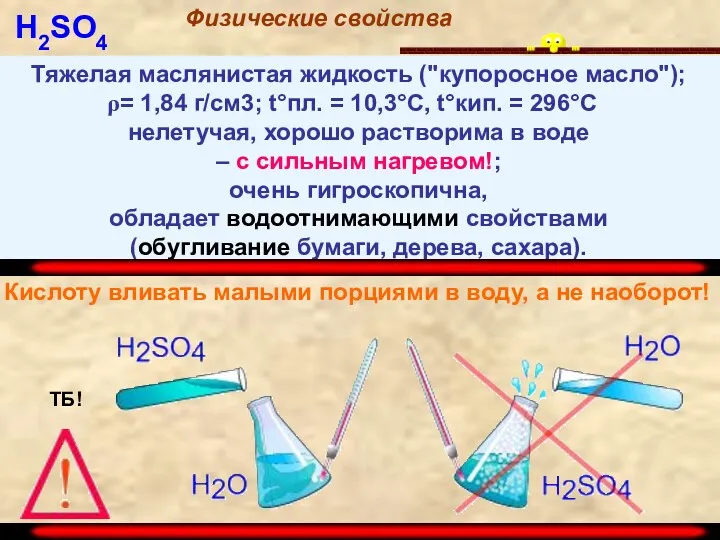
- 6. Тяжелая маслянистая жидкость ("купоросное масло"); = 1,84 г/см3; t°пл. = 10,3°C, t°кип. = 296°С нелетучая, хорошо
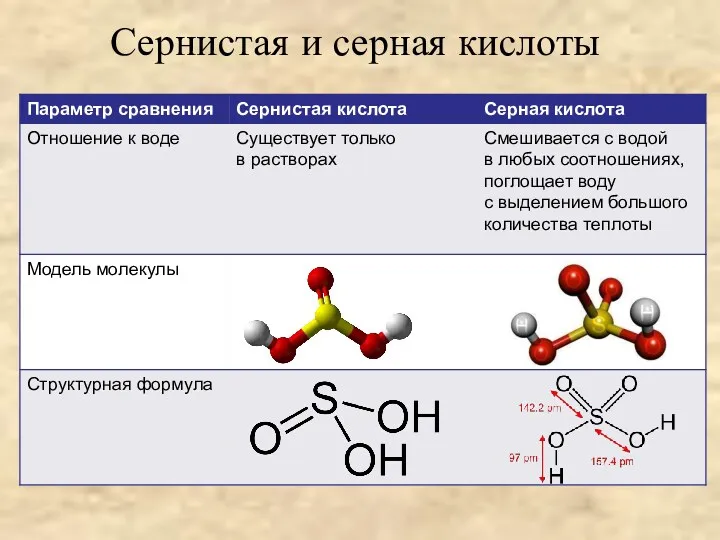
- 7. Сернистая и серная кислоты
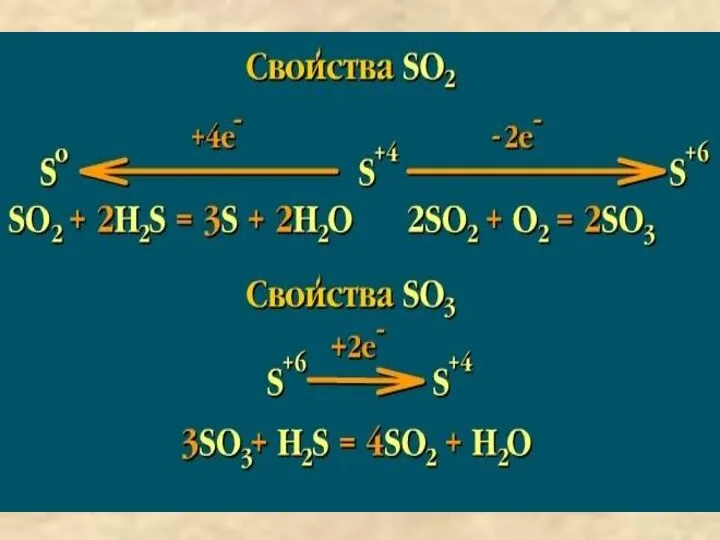
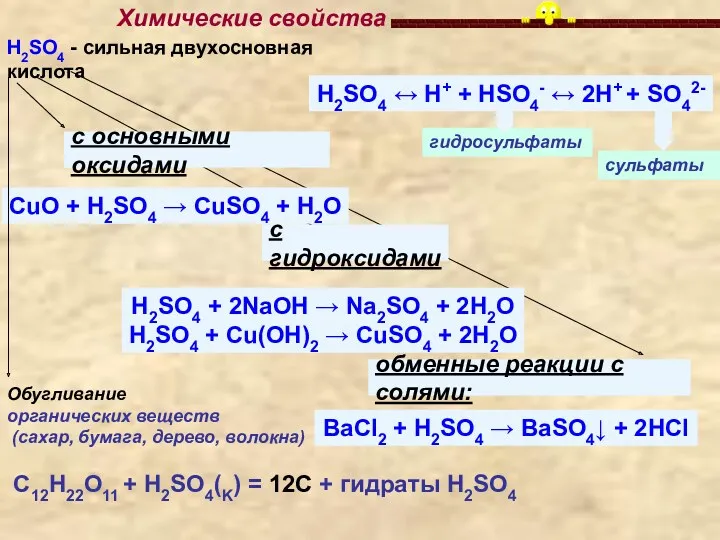
- 8. Химические свойства H2SO4 - сильная двухосновная кислота H2SO4 ↔ H+ + HSO4- ↔ 2H+ + SO42-
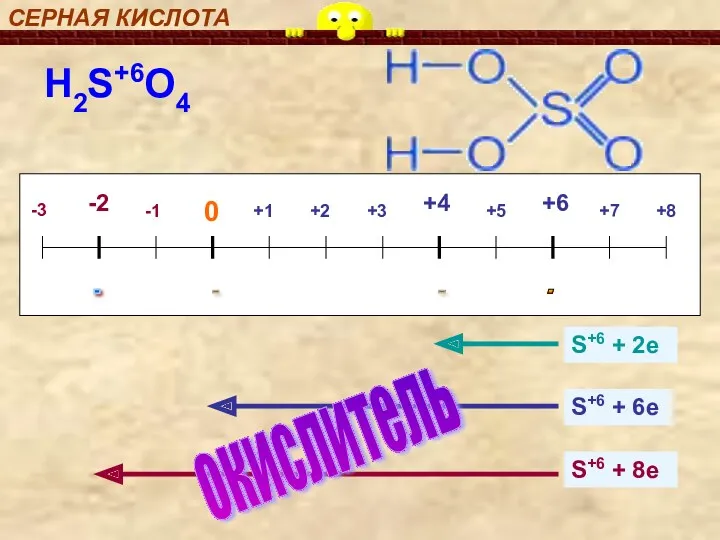
- 9. СЕРНАЯ КИСЛОТА H2S+6O4 окислитель
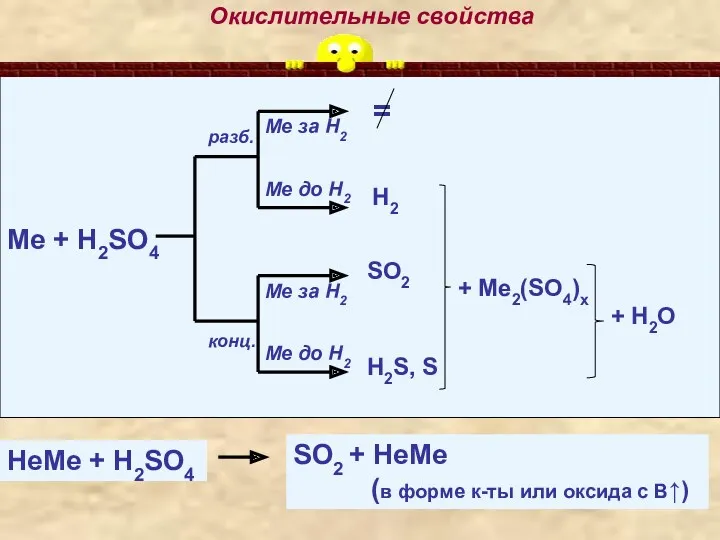
- 10. Окислительные свойства Ме + H2SO4 разб. конц. + Me2(SO4)x HeМе + H2SO4 SO2 + HeМе (в
- 11. Взаимодействие с металлами H2SO4 H2SO4 разб + Zn = Zn SO4 + H2↑ H2SO4 разб +
- 12. Отношение концентрированной серной кислоты к простым веществам-металлам а) металлы активные восстанавливают серную кислоту до сероводорода: IA
- 13. Отношение концентрированной серной кислоты к простым веществам-металлам б) металлы средней активности восстанавливают серную кислоту до сернистого
- 14. Отношение концентрированной серной кислоты к простым веществам-металлам б) металлы средней активности восстанавливают серную кислоту до сероводорода
- 15. Отношение концентрированной серной кислоты к простым веществам-металлам в) некоторые неактивные металлы (Cu, Hg, Ag) восстанавливают серную
- 16. Взаимодействие концентрированной серной кислоты с неметаллами S,P,C Окисление неметаллов: S0(тв.)+ 2H2S+6O4 (конц)→3SO2↑+2H2O S0 – восстановитель, H2SO4
- 17. Взаимодействие серной кислоты разбавленной с сульфидами металлов CuS, Cu2S, FeS, пиритом FeS2 Cu+12S–2 + H2SO4(разб.)≠ Cu+2S–2
- 18. Взаимодействие серной кислоты концентрированной с сульфидами металлов CuS, Cu2S, FeS, пиритом FeS2 Cu+2S–2 + 4H2S+6O4(конц.) →
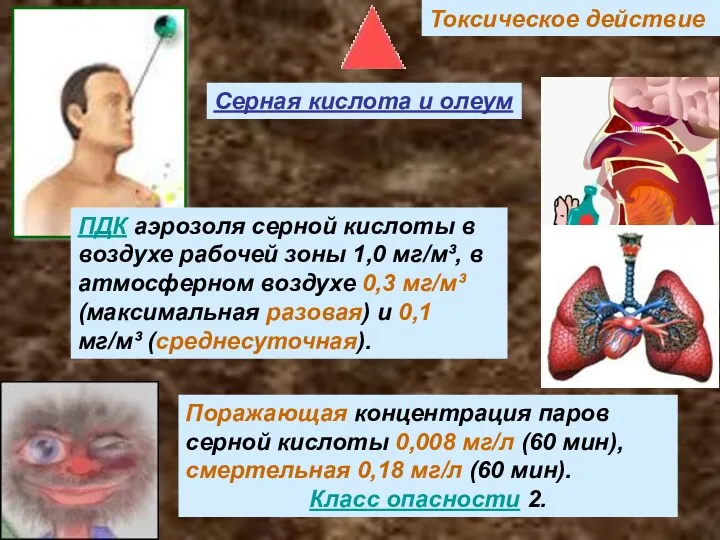
- 19. Токсическое действие Серная кислота и олеум ПДК аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м³,
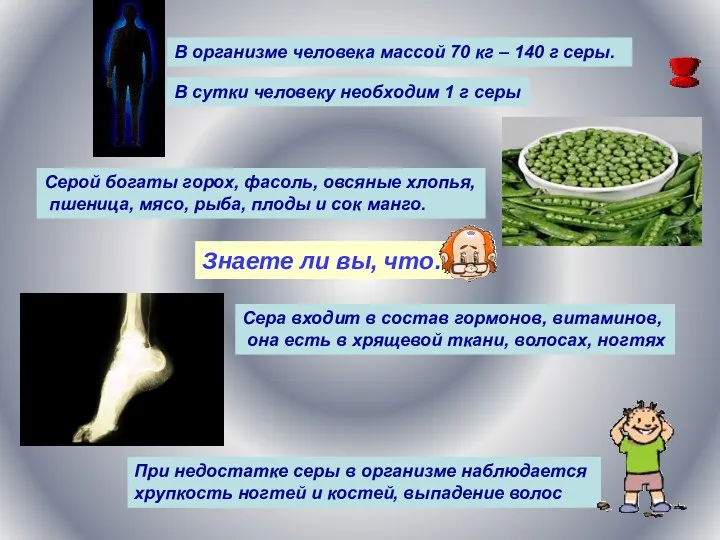
- 20. Знаете ли вы, что… Крестоцветные усваивают из почвы столько же серы, сколько фосфора. Поэтому при недостатке
- 21. Знаете ли вы, что… В организме человека массой 70 кг – 140 г серы. В сутки
- 23. Скачать презентацию










 Химия элементов VIIA группы
Химия элементов VIIA группы Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Prezentatciya
Prezentatciya Современные химические технологии
Современные химические технологии Дисперсные системы
Дисперсные системы Карбоновые кислоты
Карбоновые кислоты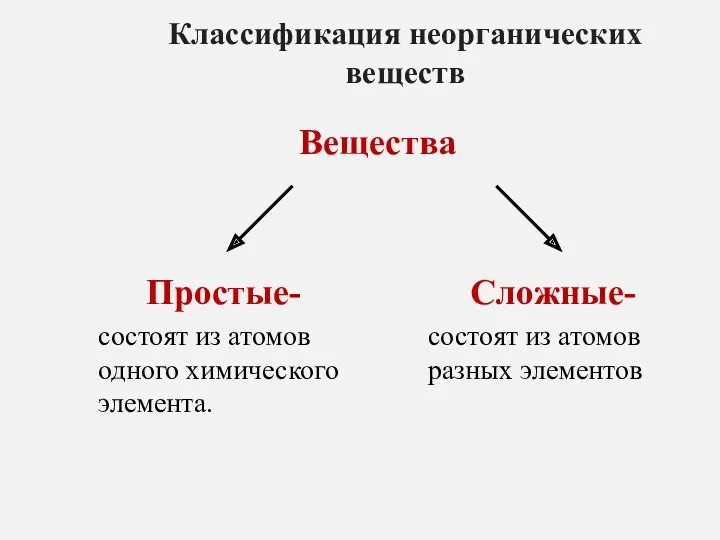 Классификация неорганических веществ
Классификация неорганических веществ Водородные соединения неметаллов. Выходное тестирование
Водородные соединения неметаллов. Выходное тестирование Физические и химические свойства аренов
Физические и химические свойства аренов Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Влияние газированных напитков на организм человека
Влияние газированных напитков на организм человека Характеристика элементов VI группы .Кислород. Озон
Характеристика элементов VI группы .Кислород. Озон Алкалоиды и принципы их классификации
Алкалоиды и принципы их классификации Негізгі топша элементтерінің химиясы
Негізгі топша элементтерінің химиясы Химия лекция (вебинар)
Химия лекция (вебинар) Алкандар. Метан және оның құрылысы
Алкандар. Метан және оның құрылысы Оксиды. 8 класс
Оксиды. 8 класс Топлива и их свойства
Топлива и их свойства Багатоатомні насичені спирти. Фізичні та хімічні властивості
Багатоатомні насичені спирти. Фізичні та хімічні властивості Спирты
Спирты Основания. 8 класс
Основания. 8 класс Анализ лекарственных форм
Анализ лекарственных форм Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Алюминий на кухне - опасный враг или верный помощник
Алюминий на кухне - опасный враг или верный помощник Степень окисления
Степень окисления Фазовые равновесия. Физическая и коллоидная химия
Фазовые равновесия. Физическая и коллоидная химия Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл
Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл Granite
Granite