Слайд 2

Общая характеристика элементов VI группы главной подгруппы
Это элементы :
кислород О
сера S
селен Se
теллур Te
полоний Ро
Группа называется халькогены
(рождающий руды)
Слайд 3

Слайд 4

Изменение наиболее важных физико-химических характеристик.
Электронная конфигурация внешнего энергетического уровня ns2np4 .
Радиусы атомов от О к Ро возрастают, ослабевают неметаллические свойства.
Электроотрицательность уменьшается от О к Ро.
Температуры плавления и кипения увеличиваются.
Плотность увеличивается.
Слайд 5
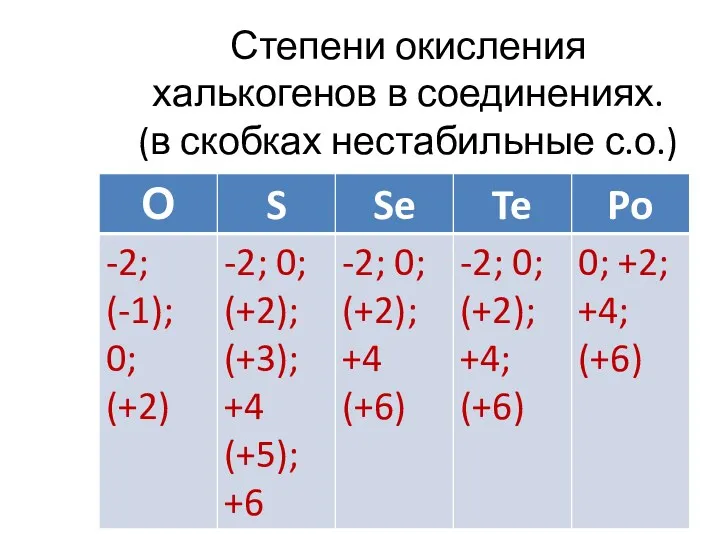
Степени окисления халькогенов в соединениях.
(в скобках нестабильные с.о.)
Слайд 6

Кислород, сера, селен – типичные неметаллы.
Устойчивость соединений с высшей степенью окисления
уменьшается.
О и S – диэлектрики (не проводят эл. ток);
Se и Te – полупроводники;
Ро – радиоактивный металл.
Слайд 7

Нахождение в природе:
Кислород. Самый распространенный на Земле элемент (49%). В водах
– 88,8% по массе, в атмосфере – 20,95% об. Входит в состав более 1500 соединений земной коры. Это основной биогенный элемент.
Сера. 15 –й по распространенности. Встречается в самородном состоянии и в составе соединений:
FeS2 – пирит, ZnS- цинковая обманка,
PbS – свинцовый блеск, HgS- киноварь, CaSO4· 2H2O – гипс и др.
Слайд 8

Селен. Очень редкий элемент, содержание 5 · 10-6%. Содержатся в вулканических
горных породах, вулканических термальных водах (38 минералов). Практического значения минералы селена не имеют. Весь промышленный селен является попутным продуктом переработки руд.
Слайд 9

Теллур. Редкий элемент
1· 10-7%. В магме, горячих подземных источниках, в
сульфидных рудах.
Полоний. Всегда присутствует в урановых и ториевых минералах. Полоний-210 содержится в табаке и табачном дыме.
Слайд 10

Простые вещества. Получение.
Кислород. (О2).
Газ, без цвета, запаха и вкуса, жидкий кислород
голубого цвета, Ткип =-182,9˚С.
Получение.
1. В промышленности: перегонка сжиженного воздуха. Первым испаряется азот (Ткип = -195,8˚С). Более чистый кислород можно получить электролизом водных растворов щелочей или солей кислородсодержащих кислот.
Слайд 11

В лаборатории:
Разложение перманганата калия при нагревании:
2KMnO4 → K2MnO4 + MnO2 +
O2↑
Разложение пероксида водорода в присутствии катализатора MnO2:
2H2O2 → 2H2O + O2↑
3. При прокаливании нитрата натрия:
2NaNO3 → 2NaNO2 + O2↑
Слайд 12

Получение кислорода на космических кораблях, подводных лодках :
Используют пероксид натрия Na2O2:
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
Слайд 13

Аллотропные модификации кислорода
ОЗОН (О3). Это газ синего цвета, с резким раздражающим
запахом. Токсичен. Сильный окислитель. При обычных условиях окисляет серебро. Дышать воздухом со значительным содержанием озона нельзя – он разрушает ткани дыхательных путей. Образуется при грозовых разрядах:
3О2 = 2О3
Слайд 14

Химические свойства кислорода.
Реакции горения, образуются оксиды.
С неметаллами:
2H2 + O2
= 2H2O
4P + 5O2 = 2P2O5
S + O2 = SO2
C + O2 = CO2
С металлами:
4AI + 3O2 = 2AI2O3
3Fe + 2O2 = Fe3O4
Слайд 15

Щелочные металлы (кроме лития) и барий при взаимодействии с кислородом образуют
пероксиды:
2Na + O2 = Na2O2
Na2O2 + 2Na = 2Na2O
литий образует оксид:
4Li + O2 = 2Li2O
Слайд 16

Взаимодействие со сложными веществами. Образуются оксиды элементов, из которых состоит молекула
сложного вещества:
2CuS + 3O2 = 2CuO + 2SO2
2H2S + O2 = 2S + 2H2O
2H2S + 3O2 = 2SO2 + 2H2O
Слайд 17

Напишите уравнения реакций горения:
а) метана
б) аммиака
















 Химическая кинетика. (Лекция 11)
Химическая кинетика. (Лекция 11) Комплекс заходів з ліквідації наслідків радіаційне небезпечної надзвичайної ситуації
Комплекс заходів з ліквідації наслідків радіаційне небезпечної надзвичайної ситуації Полипропилен
Полипропилен Высокомолекулярные соединения полимеры
Высокомолекулярные соединения полимеры Комплексные соединения
Комплексные соединения Chemistry of life
Chemistry of life Коррозия металлов. Классификация коррозионных процессов
Коррозия металлов. Классификация коррозионных процессов Оксиды серы (IV) и (VI). Серная кислота, физические и химические свойства
Оксиды серы (IV) и (VI). Серная кислота, физические и химические свойства Свинец
Свинец Алкалоиды: распространение в природе, получение, применение, способы синтеза
Алкалоиды: распространение в природе, получение, применение, способы синтеза Кобальт. Нахождение в природе. Получение
Кобальт. Нахождение в природе. Получение Смазочные материалы. Моторные масла
Смазочные материалы. Моторные масла Практическая работа №2. Наблюдение за горящей свечой
Практическая работа №2. Наблюдение за горящей свечой Коллоидная химия
Коллоидная химия Чистые вещества. Смеси. Способы разделения смесей (7 класс)
Чистые вещества. Смеси. Способы разделения смесей (7 класс) Халькогены
Халькогены Розчин та його компоненти
Розчин та його компоненти Кристаллическая решетка
Кристаллическая решетка Классы неорганических веществ
Классы неорганических веществ Элементы пятой-А группы. Азот и фосфор
Элементы пятой-А группы. Азот и фосфор Ознайомлення зі зразками пластмас. Практична робота №4
Ознайомлення зі зразками пластмас. Практична робота №4 Основания. 8 класс
Основания. 8 класс Лекция 3. Разновидности химических связей
Лекция 3. Разновидности химических связей Строение, реакционные способности и методы синтеза алкадиенов
Строение, реакционные способности и методы синтеза алкадиенов Производство серной кислоты
Производство серной кислоты Массовая доля химического элемента
Массовая доля химического элемента Классификация дисперсных систем
Классификация дисперсных систем Азотсодержащие органические соединения
Азотсодержащие органические соединения