Содержание
- 2. КЛАССИФИКАЦИЯ в эту группу соединений объединяют несколько классов: Амины Амиды Имиды Азосоединения Диазосоединения. Аминокислоты Нитросоединения Нитрозосоединения
- 3. АМИНЫ Амины могут быть рассмотрены как производные аммиака. Аминами называют органические соединения, которые получают замещением атомов
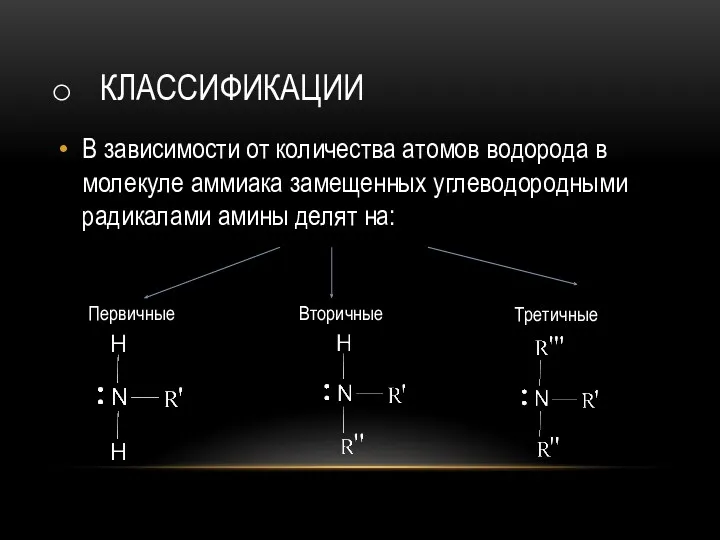
- 4. КЛАССИФИКАЦИИ В зависимости от количества атомов водорода в молекуле аммиака замещенных углеводородными радикалами амины делят на:
- 5. По типу радикалов амины делят на: Предельные; Непредельные; Ароматические. По количеству аминогрупп амины делят на: Моноамины;
- 6. НОМЕНКЛАТУРА Универсальная. Название амина строят из двух слов: названия углеводородных радикалов по радикальной номенклатуре и слова
- 10. ИЗОМЕРИЯ Положения аминогрупп Структурная (углеродного скелета) Метамерия
- 11. ФИЗИЧЕСКИЕ СВОЙСТВА Метиламин, диметиламин, триметиламин представляют собой газы. Остальные низшие амины – жидкости. Высшие амины –
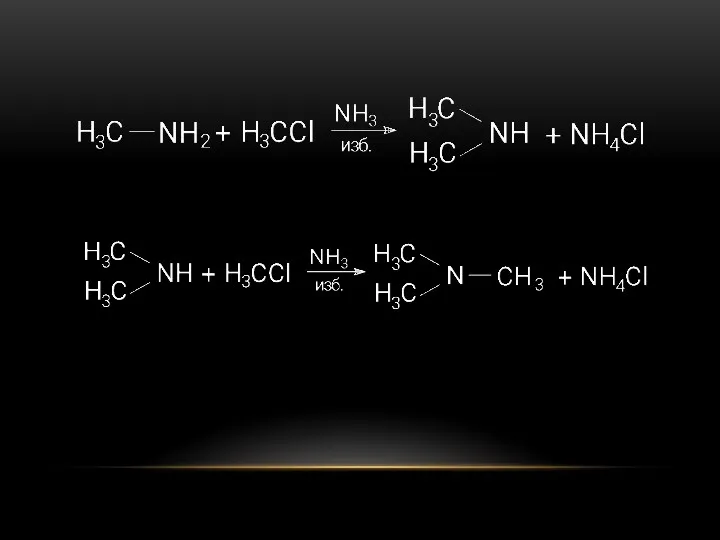
- 12. СПОСОБЫ ПОЛУЧЕНИЯ В 1850 году немецкий ученый Гофман впервые получил амин в результате химической реакции взаимодействия
- 14. Наиболее биологически активными являются первичные амины. Их получили разложением амидов кислот (перегруппировка Гофмана). Этот способ широко
- 15. В промышленности первичные амины получают восстановлением нитросоединений и нитрилов кислот.
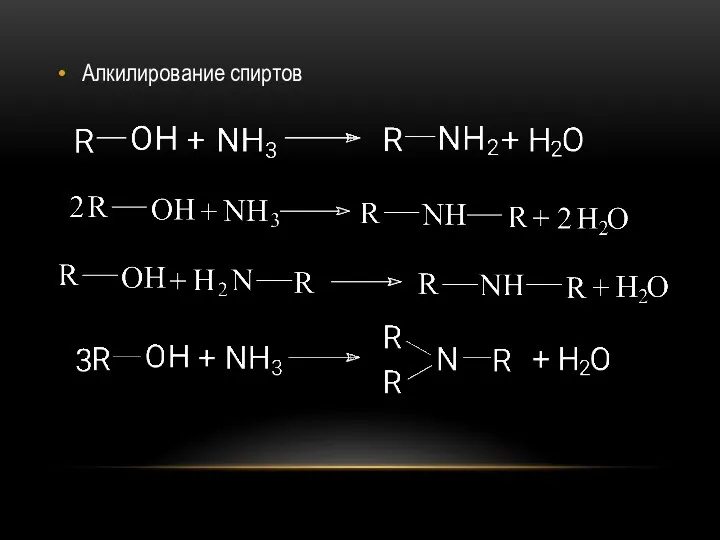
- 16. Алкилирование спиртов
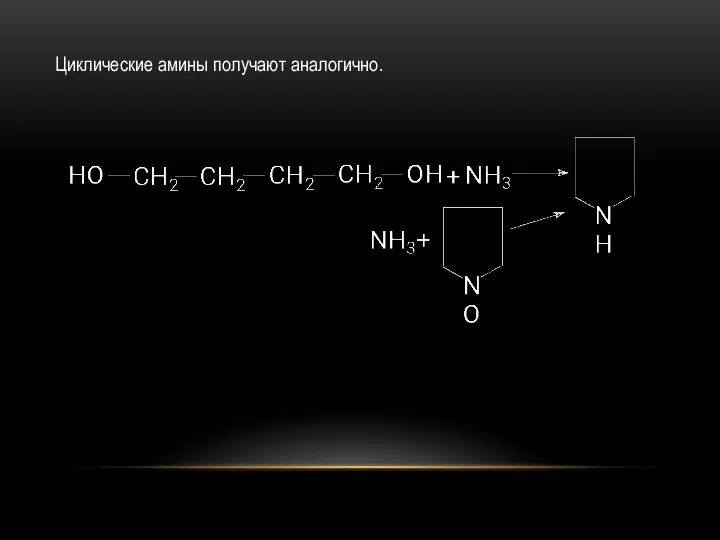
- 17. Циклические амины получают аналогично.
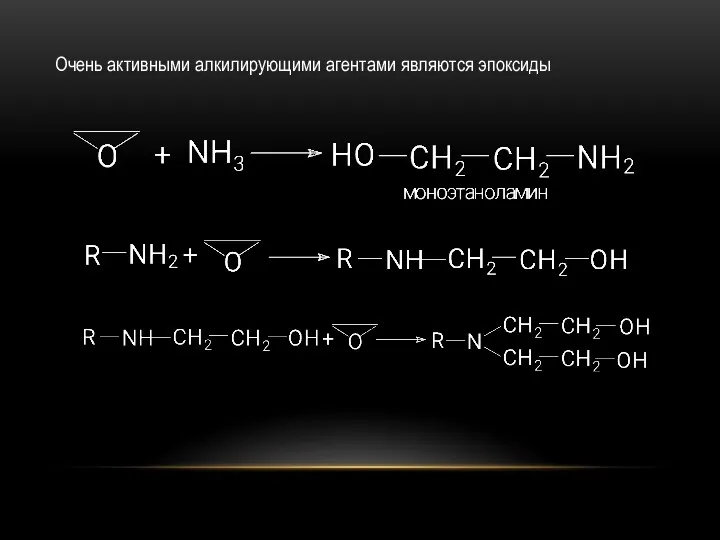
- 18. Очень активными алкилирующими агентами являются эпоксиды
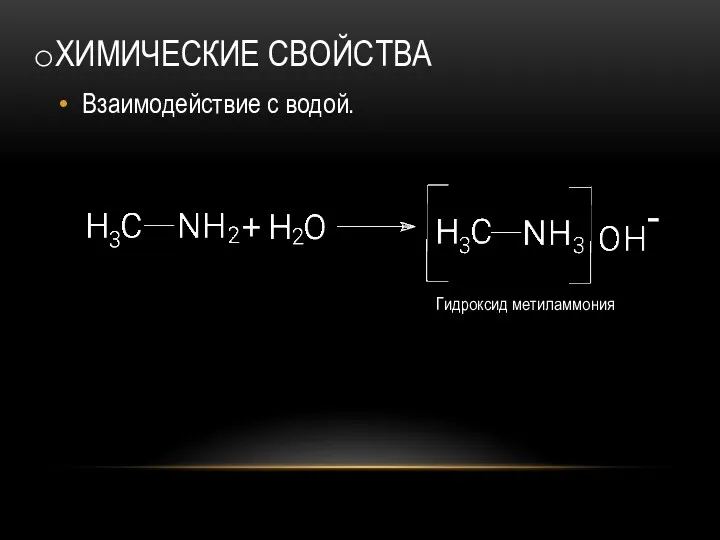
- 19. ХИМИЧЕСКИЕ СВОЙСТВА Взаимодействие с водой.
- 20. Взаимодействие с кислотами. С соляной
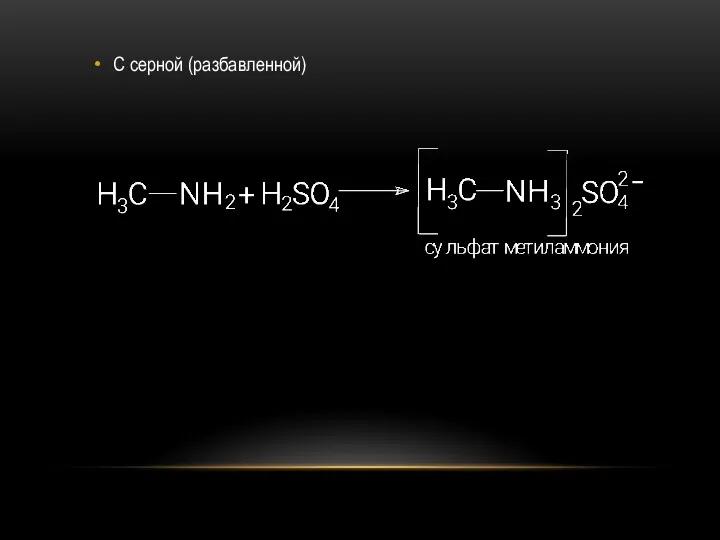
- 21. С серной (разбавленной)
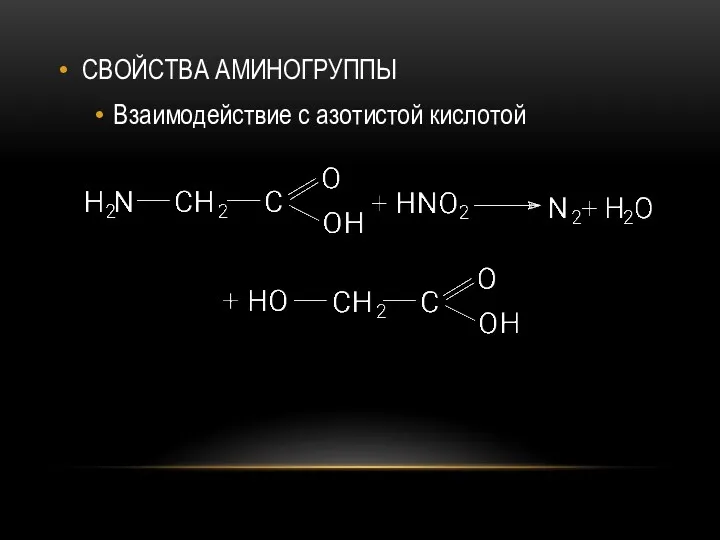
- 22. Взаимодействие с азотистой кислотой При взаимодействии первичных аминов с азотистой кислотой образуются первичные спирты.
- 23. Вторичные амины при взаимодействии с азотистой кислотой образуют нитрозамины (окрашенные соединения желто-оранжевого цвета).
- 24. Ацилирование. Взаимодействие с карбоновыми кислотами.
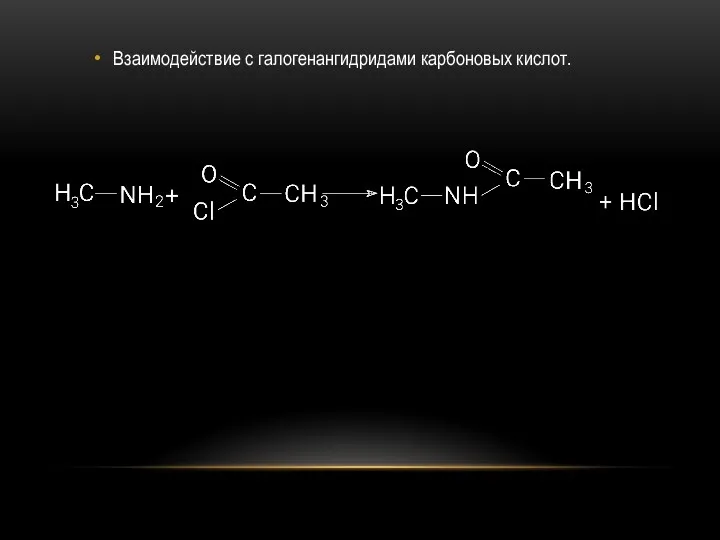
- 25. Взаимодействие с галогенангидридами карбоновых кислот.
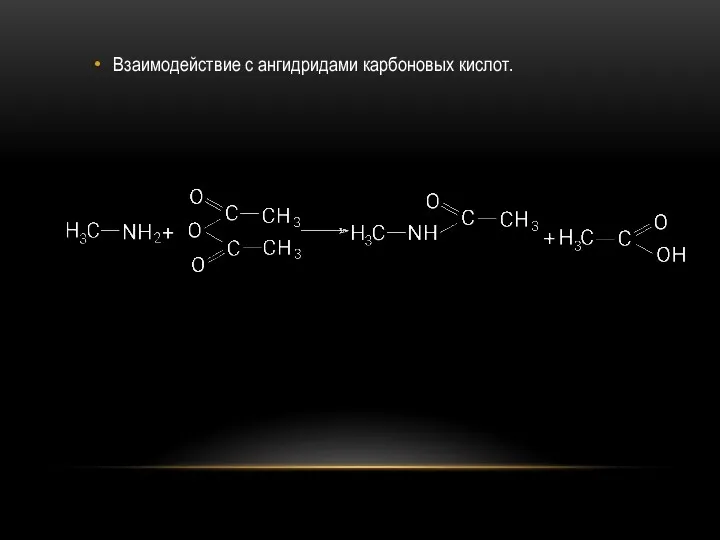
- 26. Взаимодействие с ангидридами карбоновых кислот.
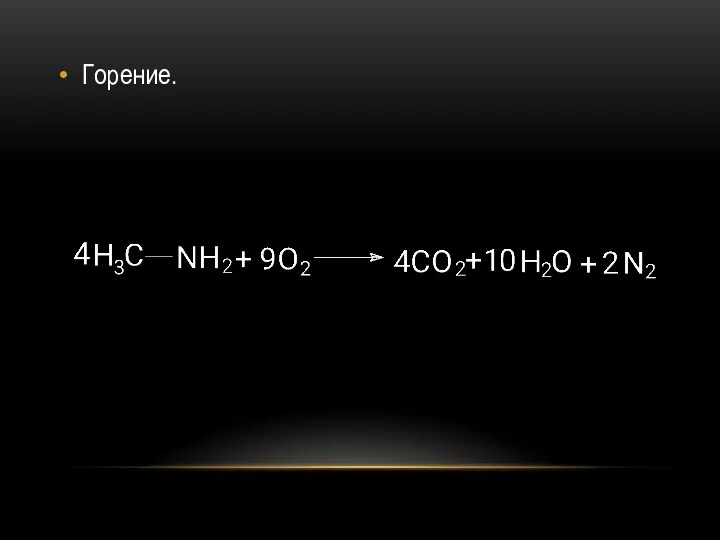
- 27. Горение.
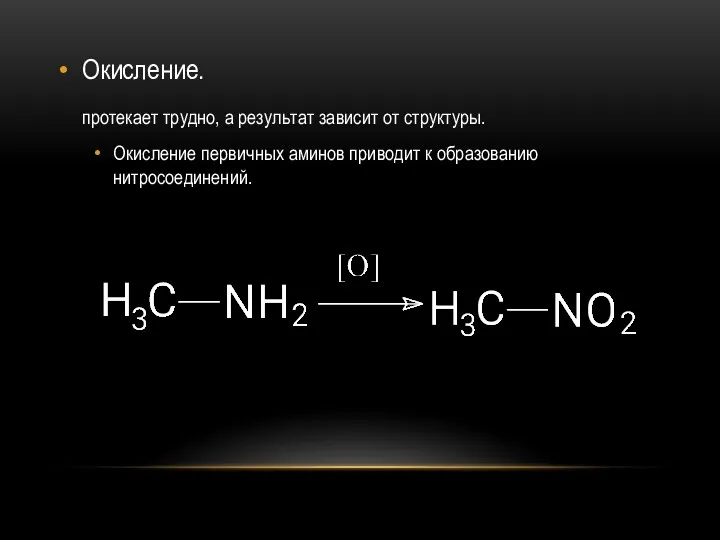
- 28. Окисление. протекает трудно, а результат зависит от структуры. Окисление первичных аминов приводит к образованию нитросоединений.
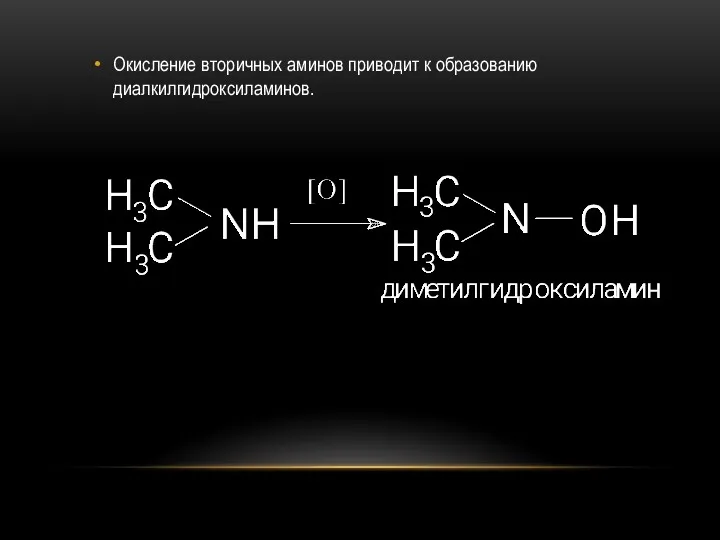
- 29. Окисление вторичных аминов приводит к образованию диалкилгидроксиламинов.
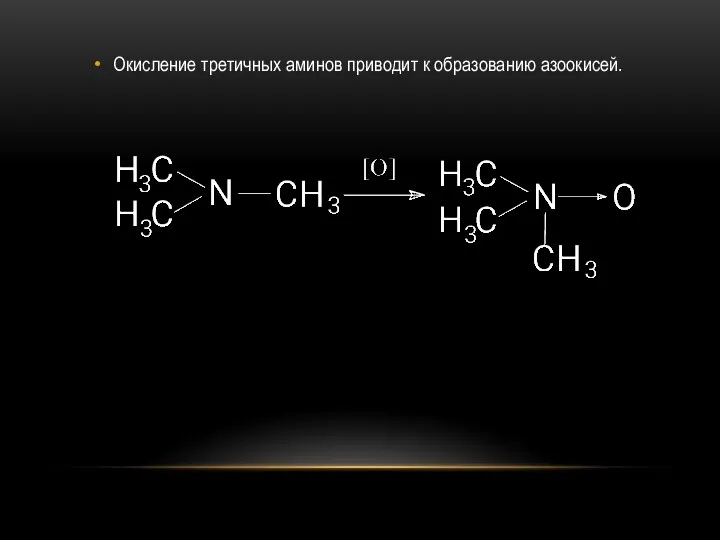
- 30. Окисление третичных аминов приводит к образованию азоокисей.
- 31. АРОМАТИЧЕСКИЕ АМИНЫ
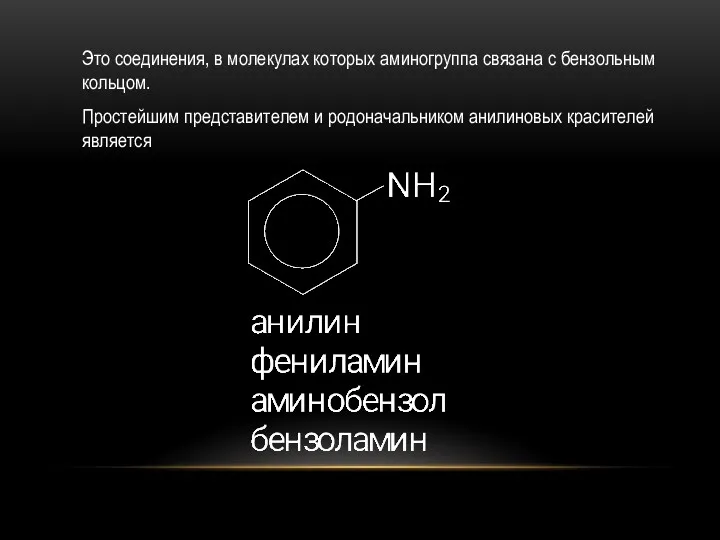
- 32. Это соединения, в молекулах которых аминогруппа связана с бензольным кольцом. Простейшим представителем и родоначальником анилиновых красителей
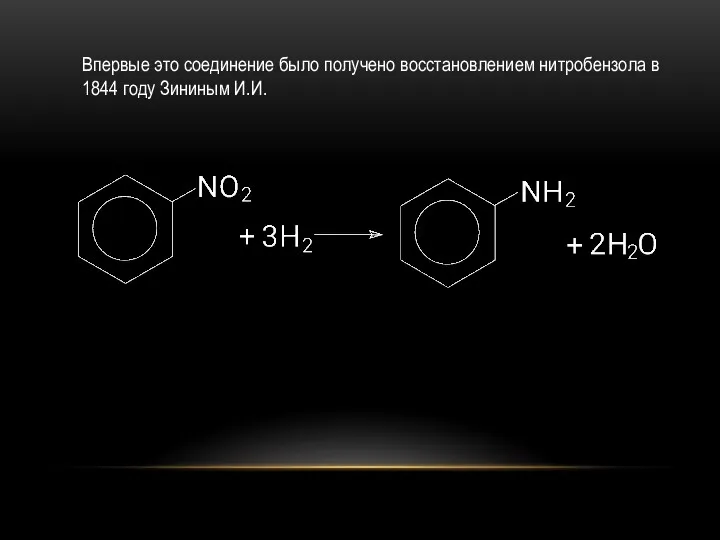
- 33. Впервые это соединение было получено восстановлением нитробензола в 1844 году Зининым И.И.
- 34. ФИЗИЧЕСКИЕ СВОЙСТВА Анилин – бесцветная, быстро буреющая на воздухе, жидкость. Плохо растворяется в воде.
- 35. ХИМИЧЕСКИЕ СВОЙСТВА обусловлены как аминогруппой, так и бензольным кольцом. Аминогруппа – заместитель электроннодонорный и свойства анилина
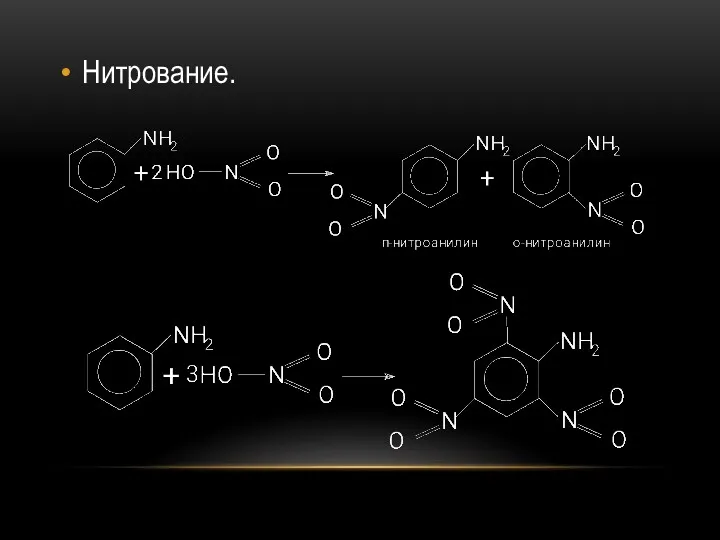
- 36. Нитрование.
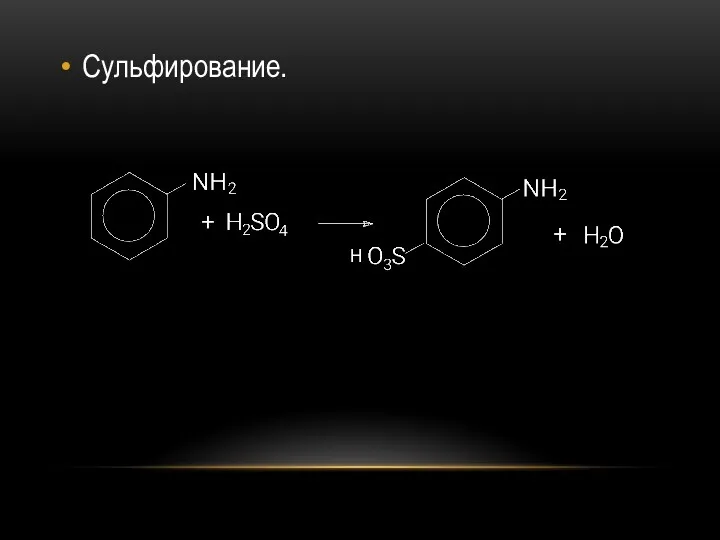
- 37. Сульфирование. H
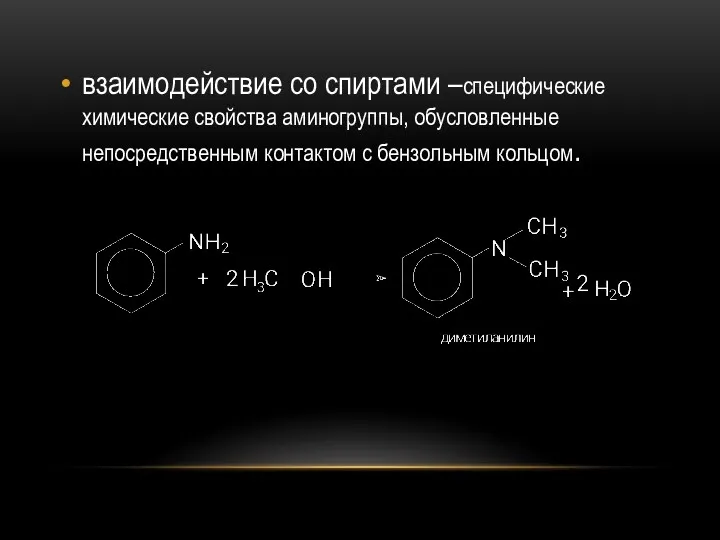
- 38. взаимодействие со спиртами –специфические химические свойства аминогруппы, обусловленные непосредственным контактом с бензольным кольцом.
- 39. АМИДЫ
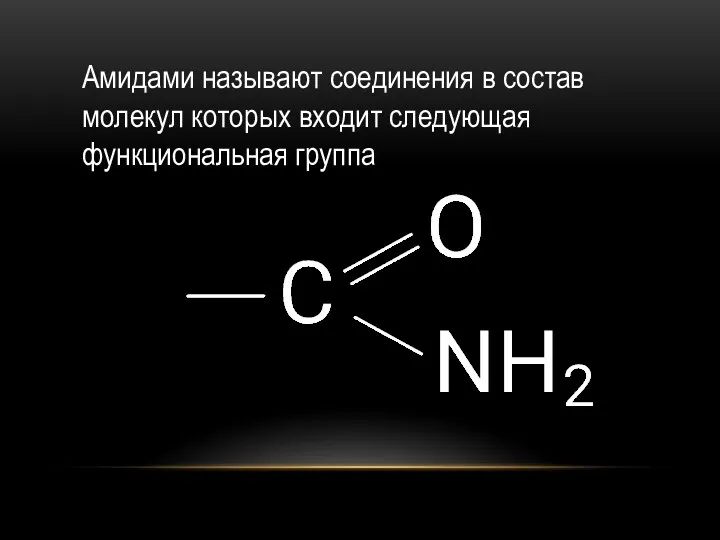
- 40. Амидами называют соединения в состав молекул которых входит следующая функциональная группа
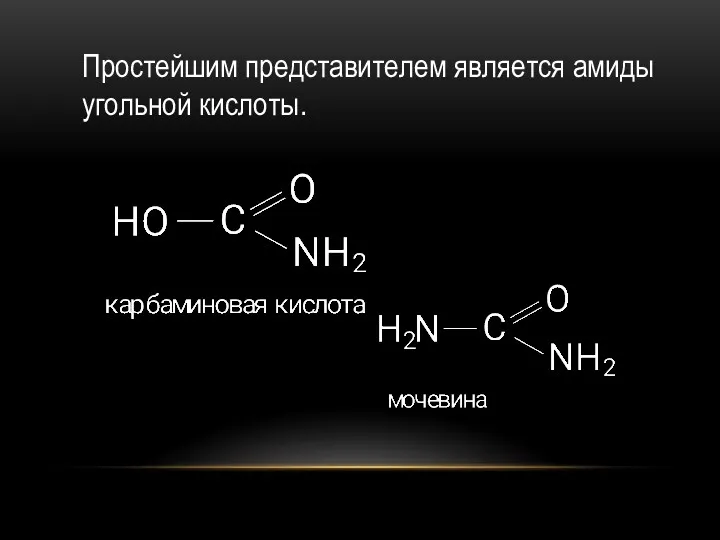
- 41. Простейшим представителем является амиды угольной кислоты.
- 42. МОЧЕВИНА является полным амидом угольной кислоты. Широко распространена в природе. Является конечным продуктом белкового обмена. При
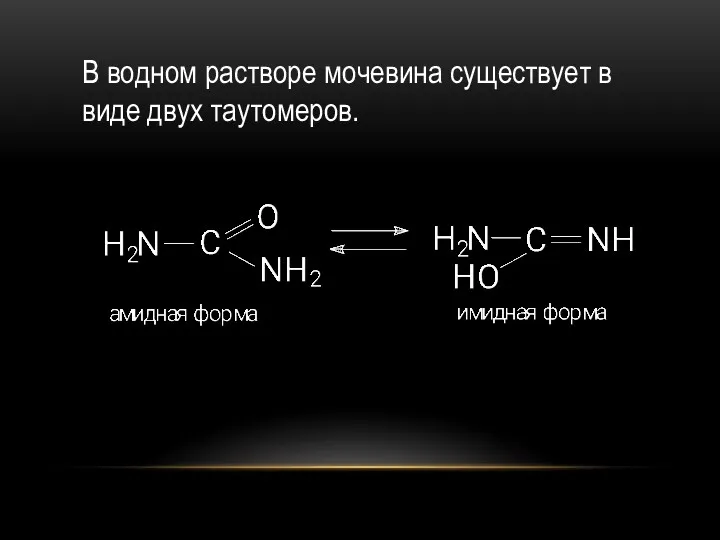
- 43. В водном растворе мочевина существует в виде двух таутомеров.
- 44. ПОЛУЧЕНИЕ МОЧЕВИНЫ В промышленности мочевину получают следующими способами: Взаимодействием полного галогенангидрида угольной кислоты с аммиаком
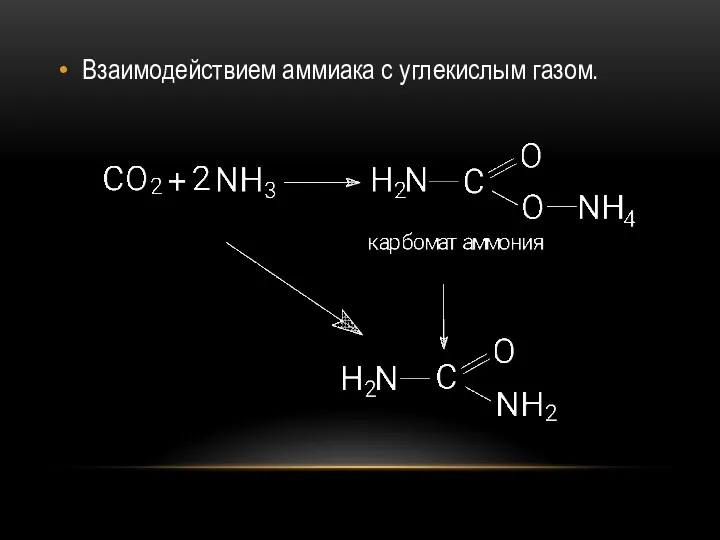
- 45. Взаимодействием аммиака с углекислым газом.
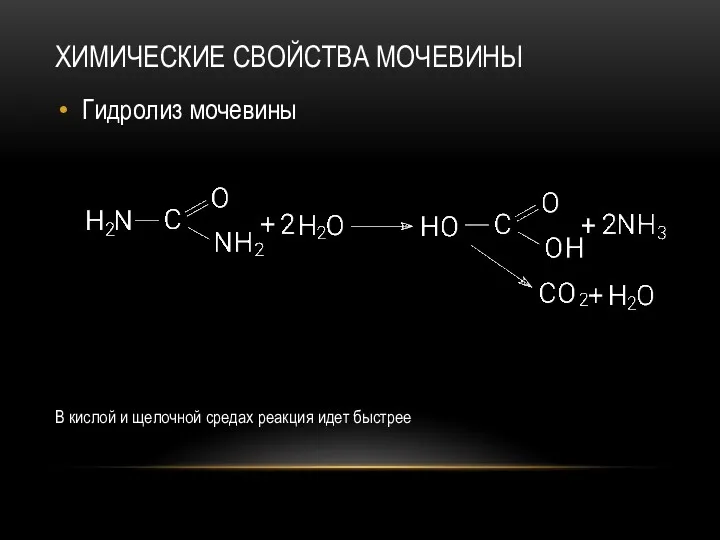
- 46. ХИМИЧЕСКИЕ СВОЙСТВА МОЧЕВИНЫ Гидролиз мочевины В кислой и щелочной средах реакция идет быстрее
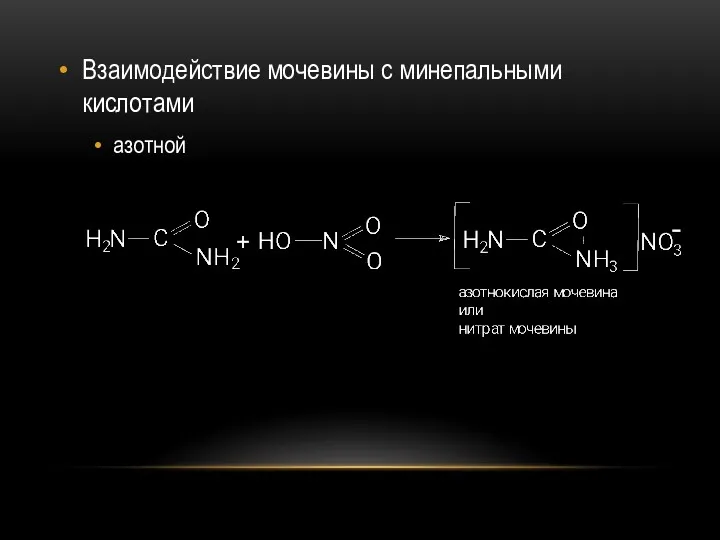
- 47. Взаимодействие мочевины с минепальными кислотами азотной
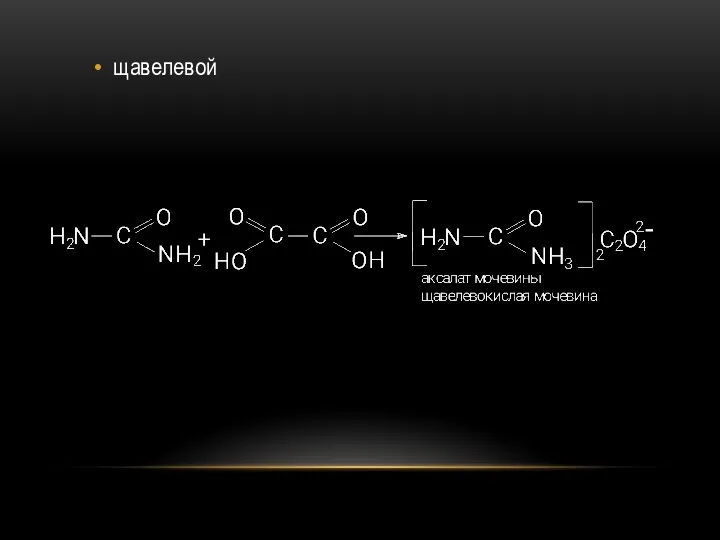
- 48. щавелевой
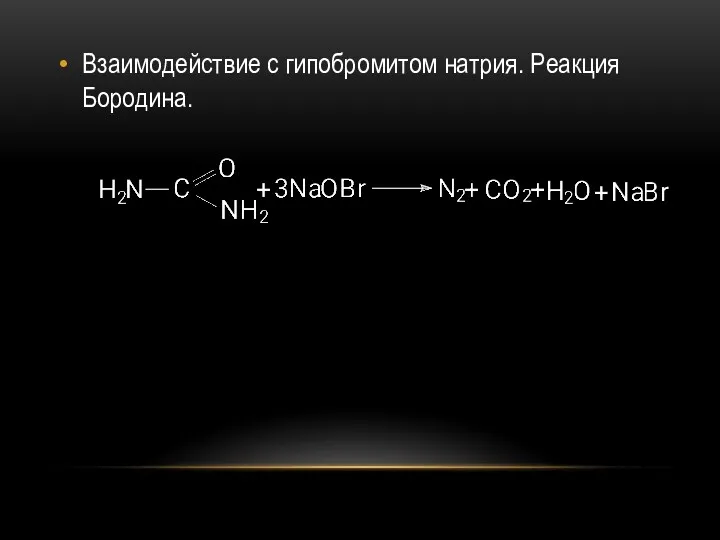
- 49. Взаимодействие с гипобромитом натрия. Реакция Бородина.
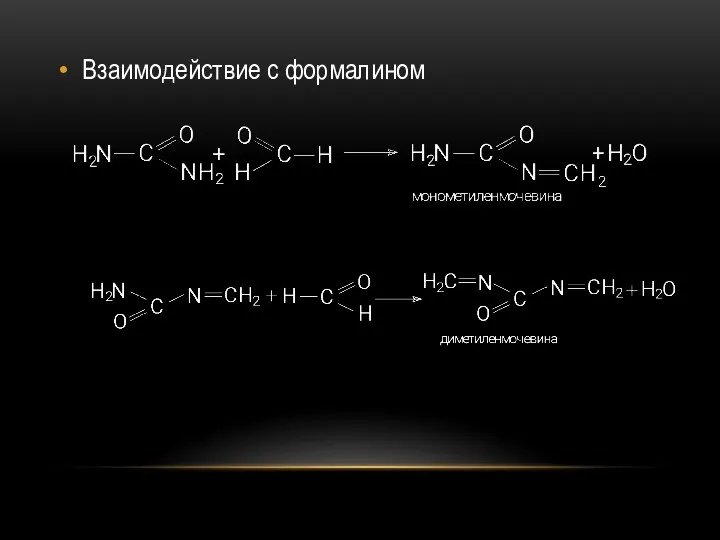
- 50. Взаимодействие с формалином
- 51. За счет разрыва двойных связей диметиленмочевина подвергается полимеризации с образованием мочевино-формальдегидных смол.
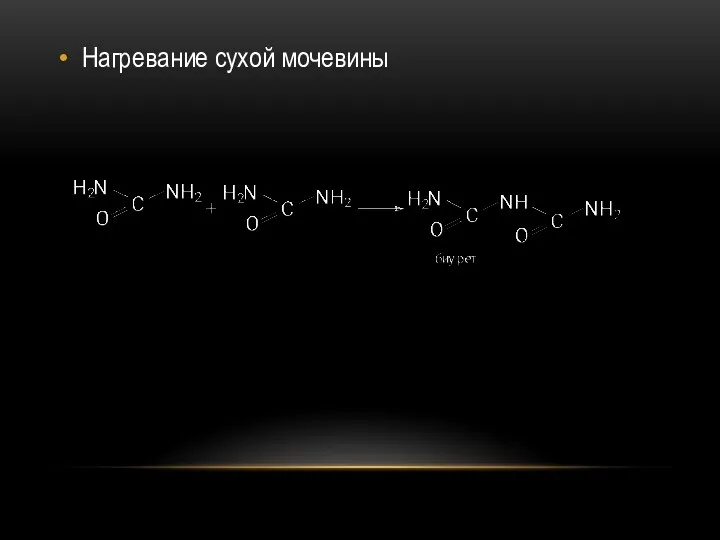
- 52. Нагревание сухой мочевины
- 53. Биурет является простейшим органическим соединением с пептидной связью. Пептидная связь является основной связью всех природных белковых
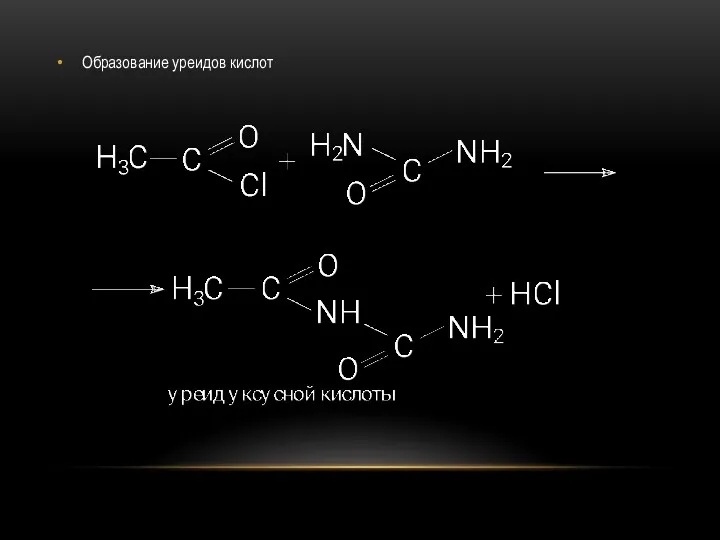
- 54. Образование уреидов кислот
- 55. АМИНОКИСЛОТЫ
- 56. Аминокислотами называют такие производные карбоновых кислот, которые можно получить замещением одного или нескольких атомов водорода в
- 57. КЛАССИФИКАЦИИ В зависимости от количества карбоксильных групп: Одноосновные Двухосновные Многоосновные
- 58. В зависимости от количества аминогрупп: Моно-аминокислоты Ди-аминокислоты Три-аминокислоты В зависимости от строения радикала: С открытой цепью
- 59. НОМЕНКЛАТУРА УНИВЕРСАЛЬНАЯ: правила построения названий такие же как для карбоновых кислот только с указанием в префиксе
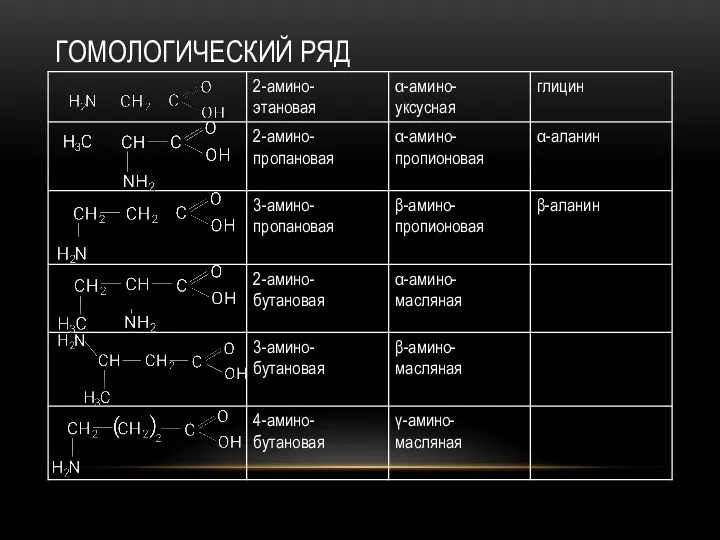
- 60. ИЗОМЕРИЯ Изомерия положения аминогруппы относительно карбоксильной группы. Различают α-, β-, γ-, δ-, ε- и т.д. Структурная
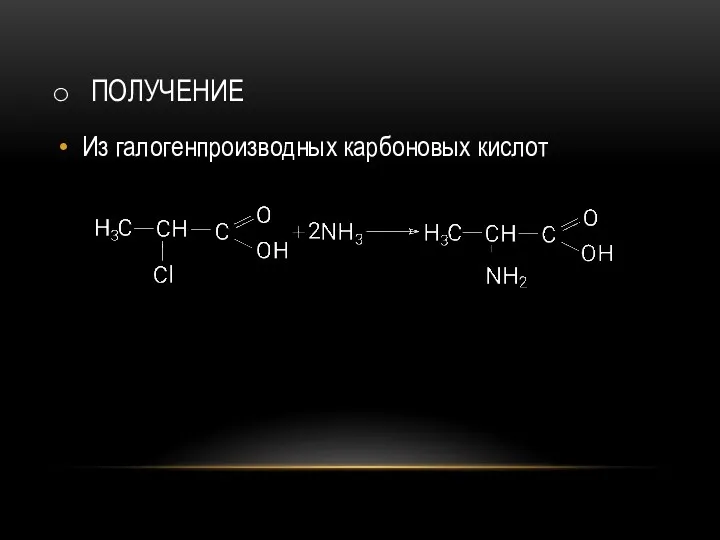
- 61. ПОЛУЧЕНИЕ Из галогенпроизводных карбоновых кислот
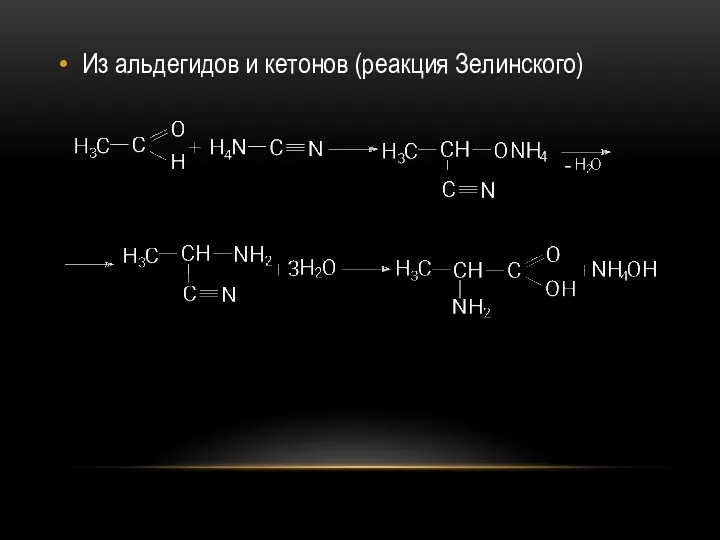
- 62. Из альдегидов и кетонов (реакция Зелинского)
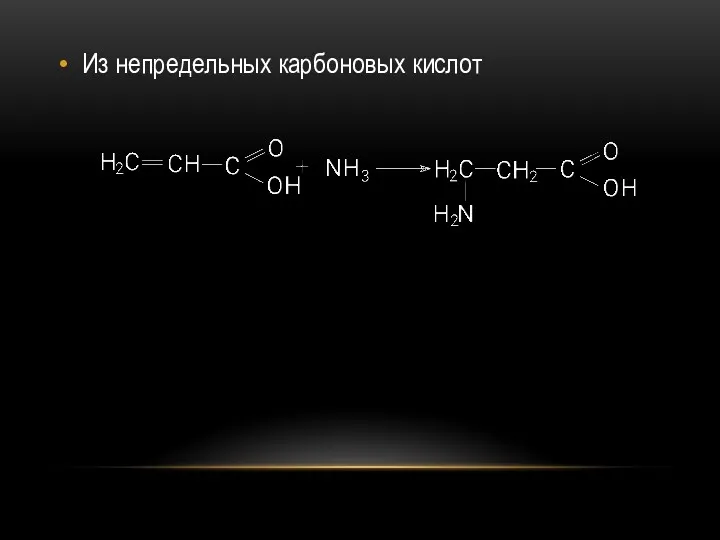
- 63. Из непредельных карбоновых кислот
- 64. ФИЗИЧЕСКИЕ СВОЙСТВА Аминокислоты – бесцветные кристаллические вещества, обладающие высокими показателями температуры плавления. Не летучи. Плавятся с
- 65. МОНОАМИНОКИСЛОТЫ
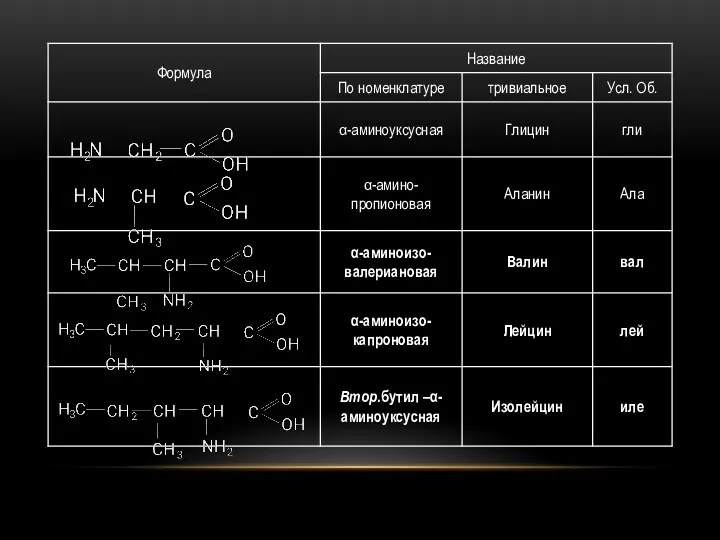
- 66. ГОМОЛОГИЧЕСКИЙ РЯД
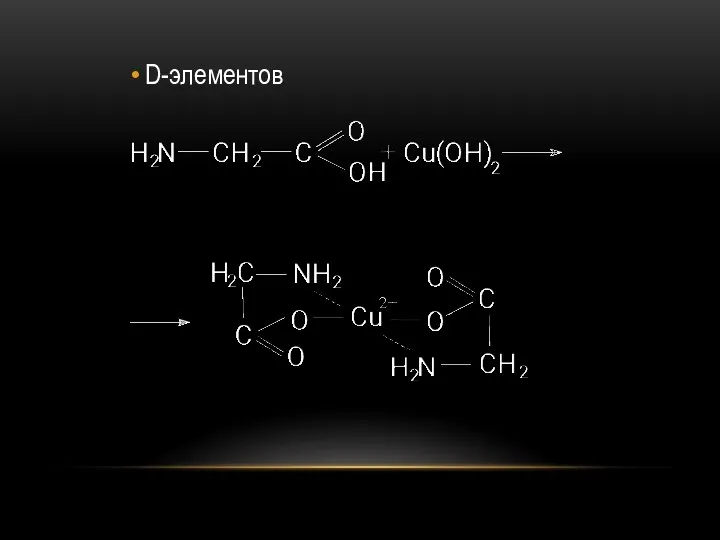
- 67. ХИМИЧЕСКИЕ СВОЙСТВА РЕАКЦИИ КАРБОКСИЛЬНОЙ ГРУППЫ Взаимодействие с гидроксидами щелочными
- 68. D-элементов
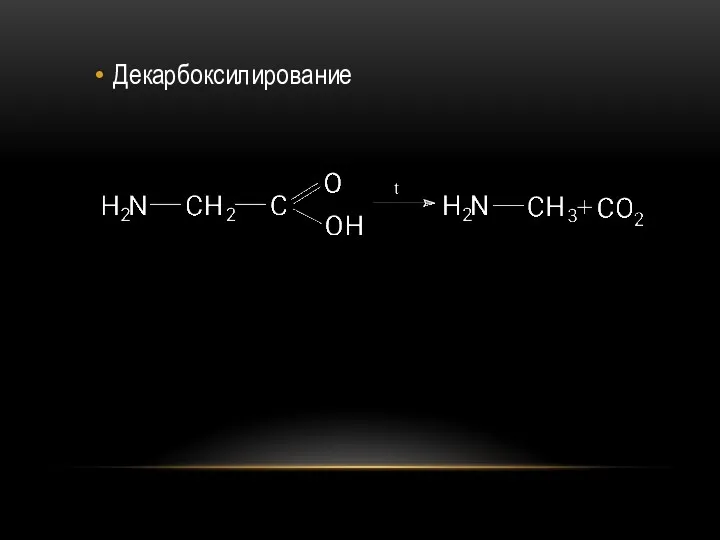
- 69. Декарбоксилирование
- 70. СВОЙСТВА АМИНОГРУППЫ Взаимодействие с азотистой кислотой
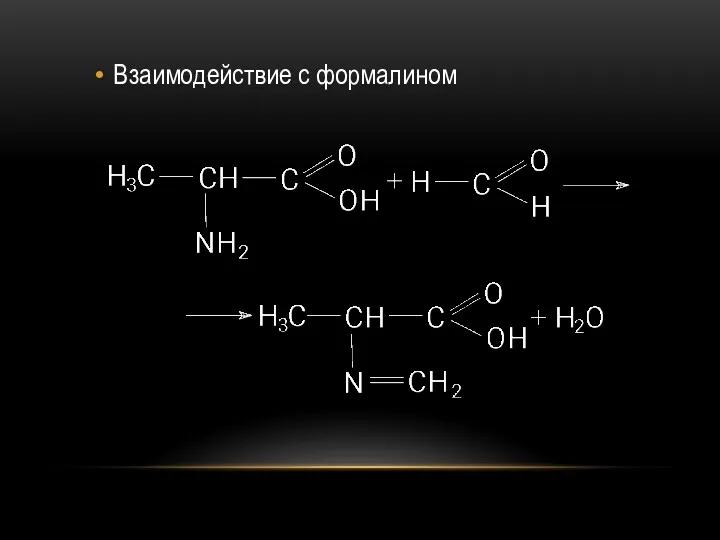
- 71. Взаимодействие с формалином
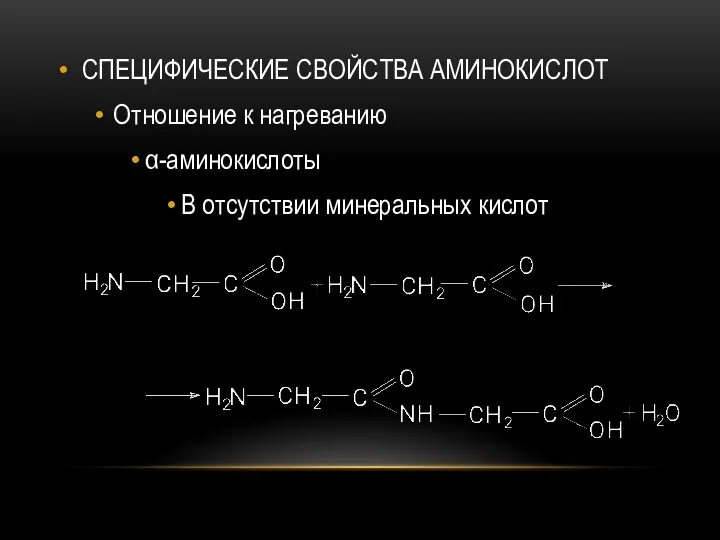
- 72. СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ Отношение к нагреванию α-аминокислоты В отсутствии минеральных кислот
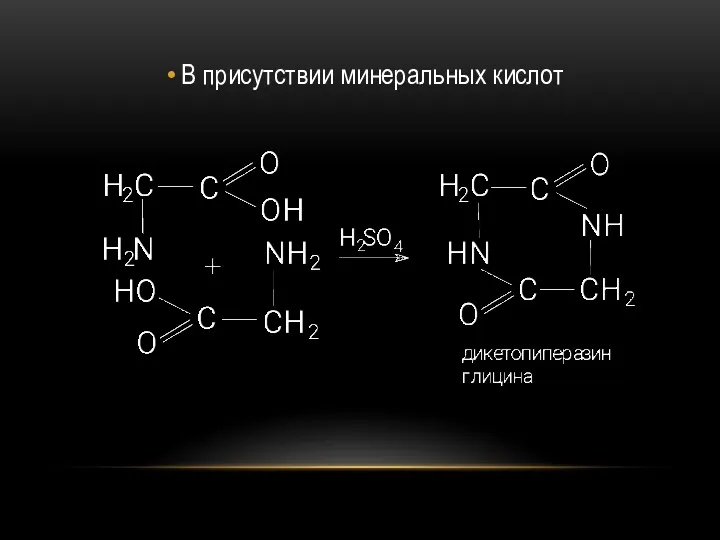
- 73. В присутствии минеральных кислот
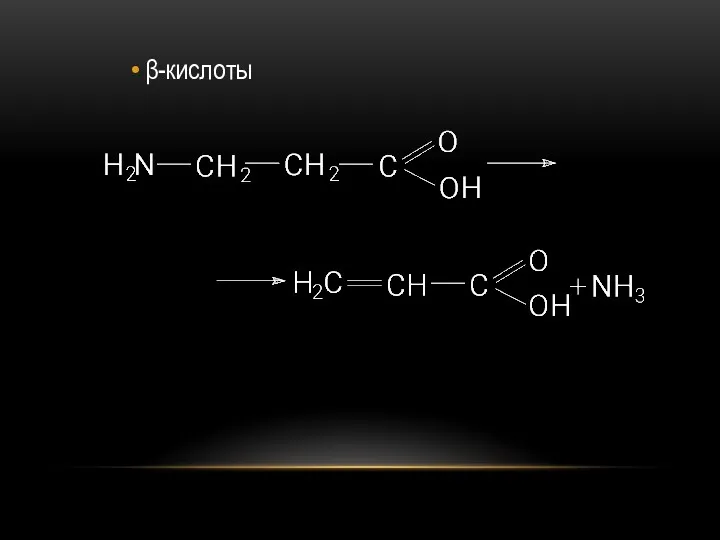
- 74. β-кислоты
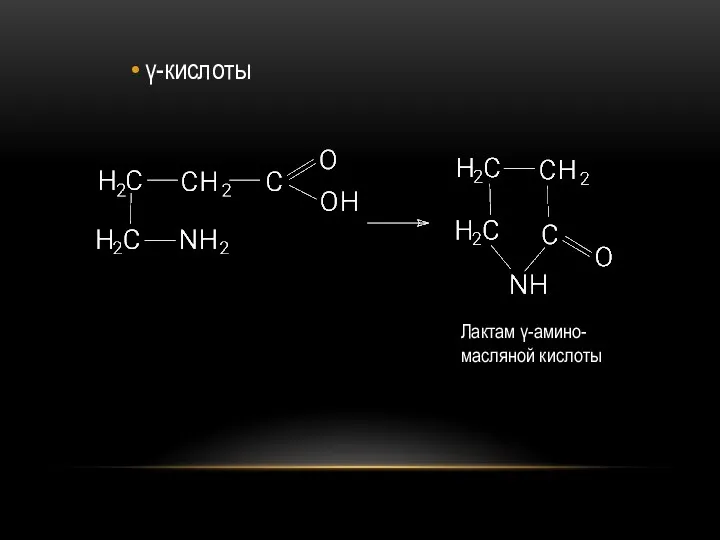
- 75. γ-кислоты Лактам γ-амино-масляной кислоты
- 76. ДВУХОСНОВНЫЕ АМИНОКИСЛОТЫ
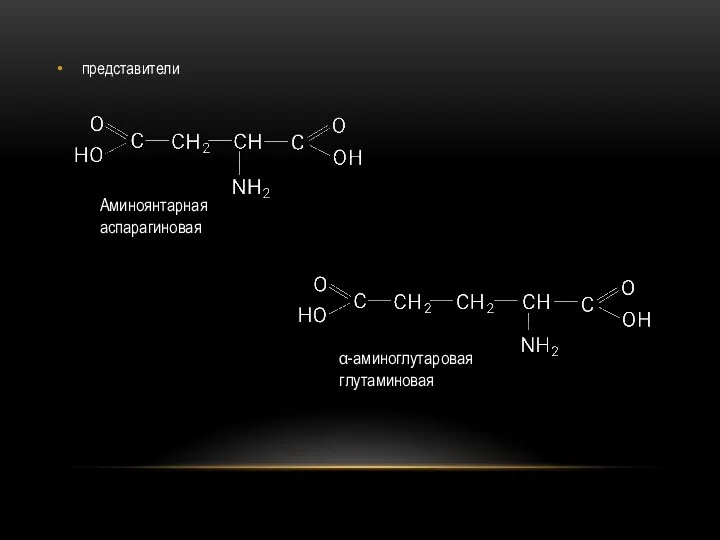
- 77. представители
- 78. Двухосновные аминокислоты способны образовывать внутренние соли. Обе встречаются среди продуктов гидролиза белковых тел. Аспарагиновая кислота в
- 79. ДИАМИНОКИСЛОТЫ
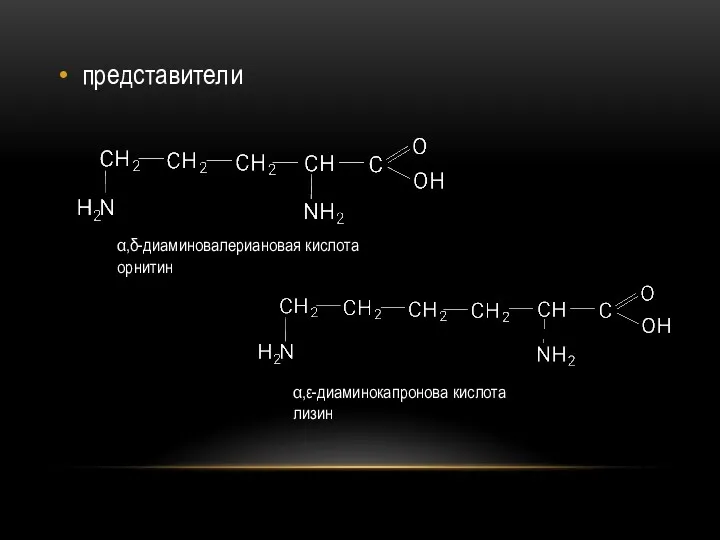
- 80. представители
- 81. ХИМИЧЕСКИЕ СВОЙСТВА Взаимодействие с водой (в водных растворах pH>7)
- 82. Декарбоксилирование
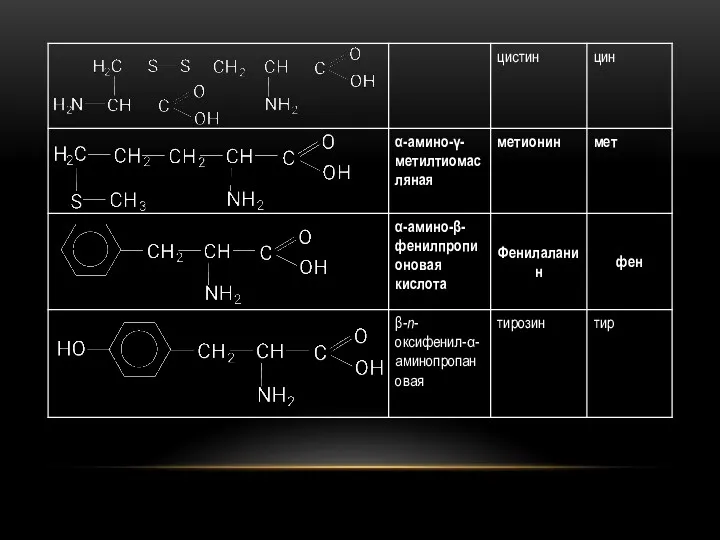
- 83. α-аминокислоты участвуют в синтезе белка. В состав белковых тел входят и такие аминокислоты, которые кроме аминогрупп
- 89. БЕЛКИ Белками, или белковыми веществами, называют высокомолекулярные органические соединения, молекулы которых построены из остатков α-аминокислот, связанных
- 90. БЕЛКИ Различают первичную, вторичную, третичную и четвертичную структуры белковых молекул. Все белки, независимо от того к
- 91. БЕЛКИ Глобулины – не растворимы в чистой воде, но растворимы в теплом 10%-ном растворе NaCl. Проламины
- 93. Скачать презентацию













































 Возобновляемое сырье органической химии
Возобновляемое сырье органической химии Електроннокаталітична переробка діоксиду вуглецю в формальдегід та метанол при атмосферному тиску
Електроннокаталітична переробка діоксиду вуглецю в формальдегід та метанол при атмосферному тиску Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс
Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс Поліметилметакрилат
Поліметилметакрилат Elements of group 2 (IIA)
Elements of group 2 (IIA) Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Прості й складні речовини. Хімічні формули. Метали і неметали
Прості й складні речовини. Хімічні формули. Метали і неметали Хімічні формули речовин
Хімічні формули речовин Кислородные соединения азота
Кислородные соединения азота Альтернативная елочка из кристаллов
Альтернативная елочка из кристаллов Генетическая связь между основными классами неорганических соединений
Генетическая связь между основными классами неорганических соединений Моносахариды. Изомерия моносахаридов
Моносахариды. Изомерия моносахаридов Мыло. Синтетические моющие средства
Мыло. Синтетические моющие средства Катионы IV, V, VI аналитических групп
Катионы IV, V, VI аналитических групп Задания С 3 для подготовки к ГИА -9 по химии
Задания С 3 для подготовки к ГИА -9 по химии Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Углеводы, липиды
Углеводы, липиды Углеводы. Урок №9. 9 класс
Углеводы. Урок №9. 9 класс Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн
Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн Електроліти в сучасних акумуляторах
Електроліти в сучасних акумуляторах Воздух и его состав
Воздух и его состав 20230816_himiya_spirty
20230816_himiya_spirty Алкены. Этилен, его получение
Алкены. Этилен, его получение Живая» и «мёртвая» вода
Живая» и «мёртвая» вода Химические свойства металлов
Химические свойства металлов Биофизические основы патологии клетки. Свободные радикалы и болезни человека
Биофизические основы патологии клетки. Свободные радикалы и болезни человека Электронный помощник по химии 8 класс
Электронный помощник по химии 8 класс Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева