Содержание
- 2. Спирты. Их состав и строение. Спирты́ — это органические соединения, содержащие одну или более гидроксильных групп,
- 3. Классификация спиртов: По строению углеводородного радикала По числу гидроксильных групп –OH По характеру атома углерода
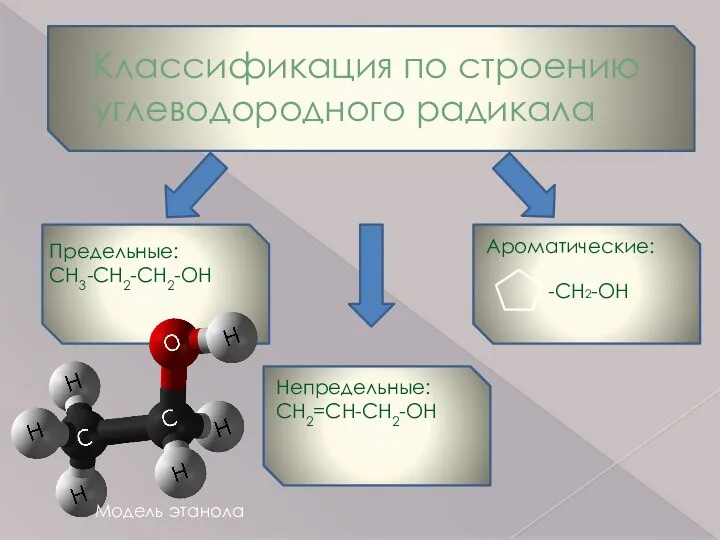
- 4. Классификация по строению углеводородного радикала Предельные: CH3-CH2-CH2-OH Непредельные: CH2=CH-CH2-OH Ароматические: -CH2-OH Модель этанола
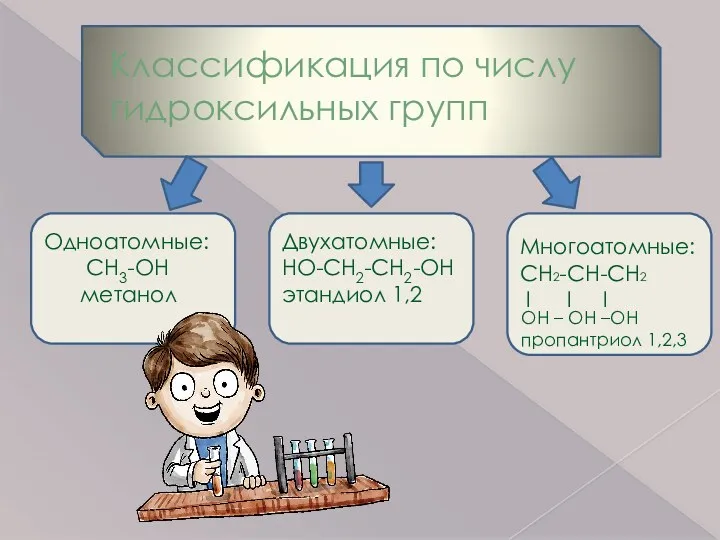
- 5. Классификация по числу гидроксильных групп Одноатомные: CH3-OH метанол Двухатомные: HO-CH2-CH2-OH этандиол 1,2 Многоатомные: CH2-CH-CH2 I I
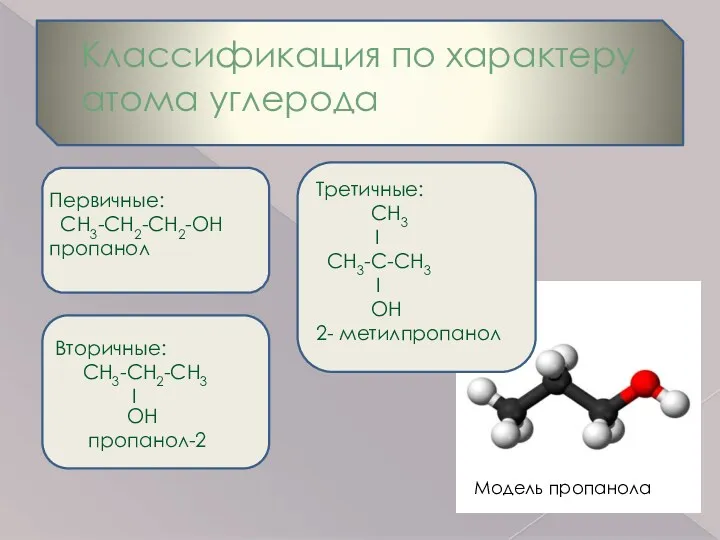
- 6. Классификация по характеру атома углерода Первичные: СН3-СН2-СН2-ОН пропанол Вторичные: СН3-СН2-СН3 I OH пропанол-2 Третичные: СH3 I
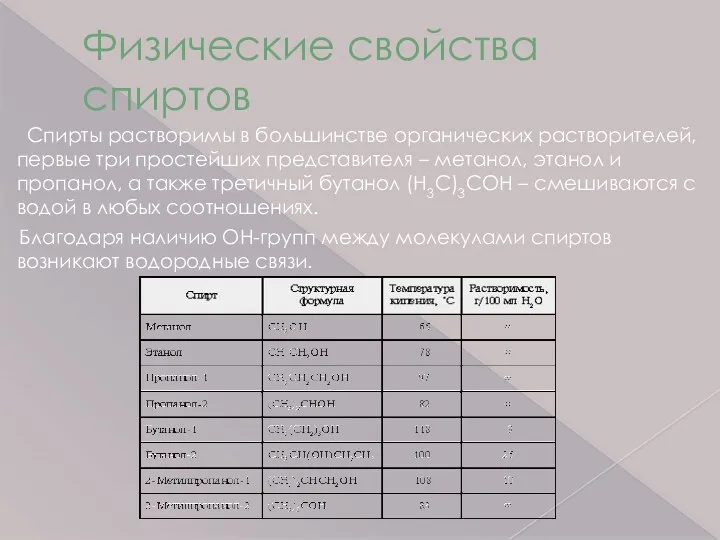
- 7. Физические свойства спиртов Спирты растворимы в большинстве органических растворителей, первые три простейших представителя – метанол, этанол
- 8. Химические свойства Спирты, как и все органические соединения, горят. Метанол и этанол мгновенно загораются при поджигании
- 9. Благодаря тому, что электронная плотность связи OH смещена к атому кислороду, атом водорода приобретает большую подвижность
- 10. Спирты вступают в реакции дегидратации (отщепление воды). Так, если этанол нагреть выше 170 ° С в
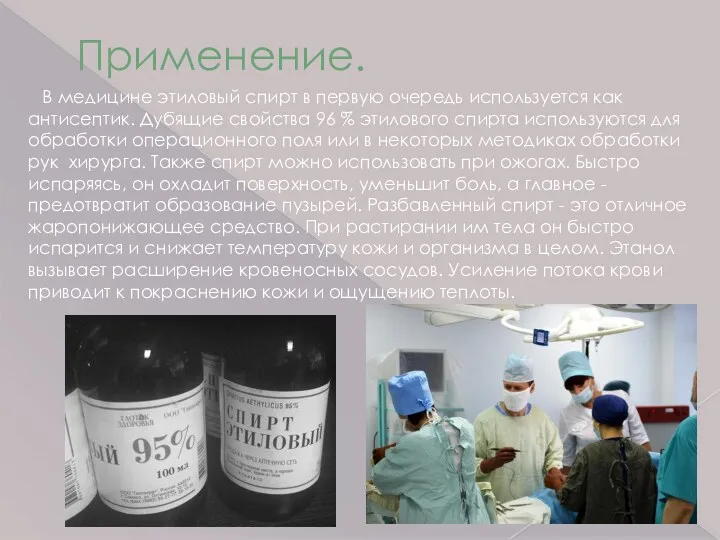
- 11. Применение. В медицине этиловый спирт в первую очередь используется как антисептик. Дубящие свойства 96 % этилового
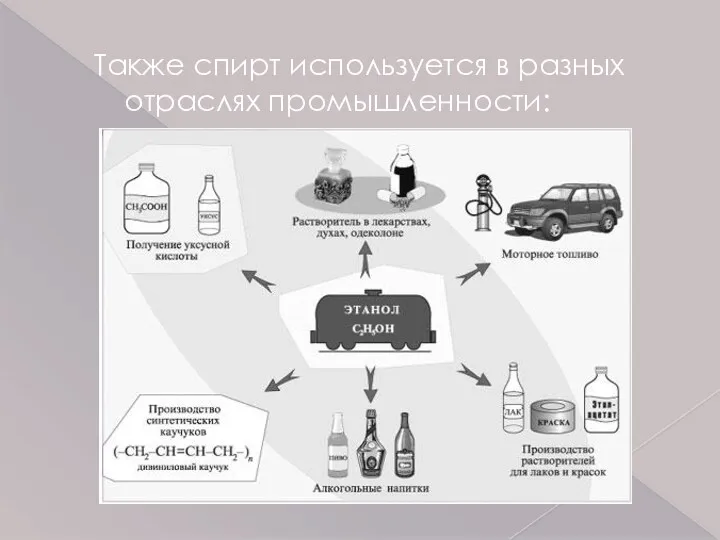
- 12. Также спирт используется в разных отраслях промышленности:
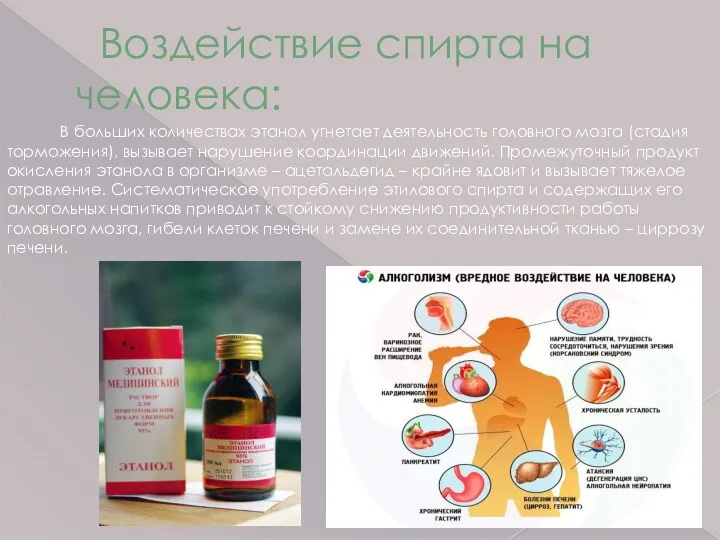
- 13. Воздействие спирта на человека: В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение
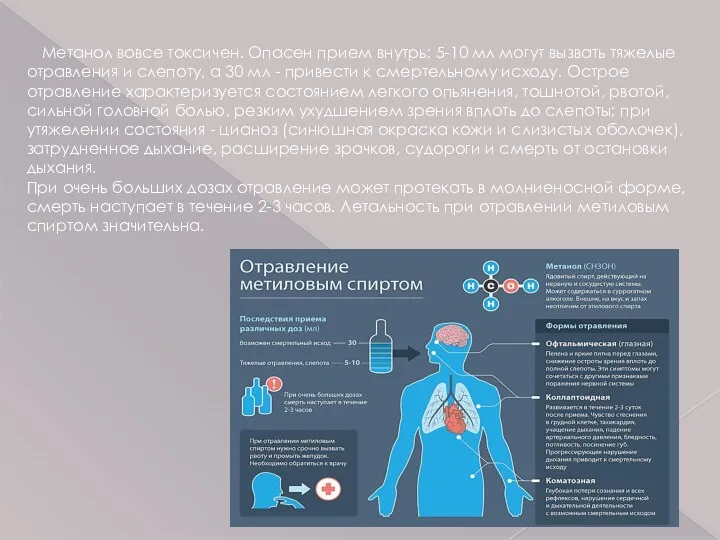
- 14. Метанол вовсе токсичен. Опасен прием внутрь: 5-10 мл могут вызвать тяжелые отравления и слепоту, а 30
- 15. Пример продукции произведенной с использованием этилового спирта. УПОТРЕБЛЕНИЕ АЛКОГОЛЯ НЕСЁТ ВРЕД ВАШЕМУ ЗДОРОВЬЮ!!!!
- 17. Скачать презентацию






 Различные теории кислот и оснований
Различные теории кислот и оснований Электролитическая диссоциация. Положительно-заряженный электрод
Электролитическая диссоциация. Положительно-заряженный электрод Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Энергетика химических процессов. Термодинамика. (Лекция 4)
Энергетика химических процессов. Термодинамика. (Лекция 4) Тренувальні вправи. Задачі
Тренувальні вправи. Задачі Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью
Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью Карбоновые кислоты
Карбоновые кислоты Метали IV групи побічної підгрупи (Ti, Zr, Hf)
Метали IV групи побічної підгрупи (Ti, Zr, Hf) Типы химических реакций
Типы химических реакций Общая характеристика металлов главных подгрупп I-III групп ПСХЭ Д.И. Менделеева
Общая характеристика металлов главных подгрупп I-III групп ПСХЭ Д.И. Менделеева Химические и физические свойства воды
Химические и физические свойства воды Каучук туралы жалпы мәліметтер
Каучук туралы жалпы мәліметтер Чисті речовини та суміші. Основні способи розділення сумішей (7 клас)
Чисті речовини та суміші. Основні способи розділення сумішей (7 клас) Химический элемент алюминий
Химический элемент алюминий Спирты
Спирты Типы химических реакций
Типы химических реакций Электролиты и неэлектролиты. Механизм электролитической диссоциации
Электролиты и неэлектролиты. Механизм электролитической диссоциации Теория электролитической диссоциации
Теория электролитической диссоциации Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Механизмы органических реакций
Механизмы органических реакций Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии
Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии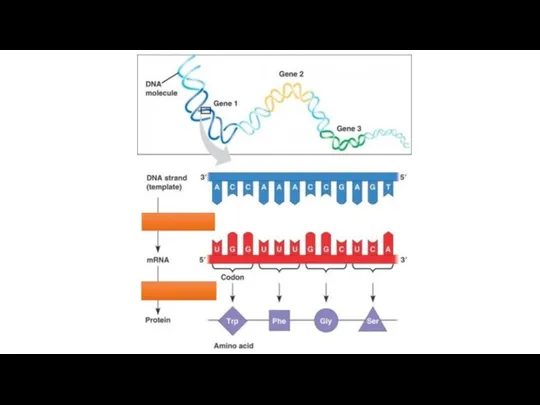 The translation and transcription
The translation and transcription Основи. Фізичні властивості основ
Основи. Фізичні властивості основ Готовимся к экзамену по химии. 9 класс
Готовимся к экзамену по химии. 9 класс Ионоселективные электроды
Ионоселективные электроды Виртуозы химического эксперимента
Виртуозы химического эксперимента Химический состав воздуха
Химический состав воздуха Типы химических соединений, номенклатура, свойства
Типы химических соединений, номенклатура, свойства