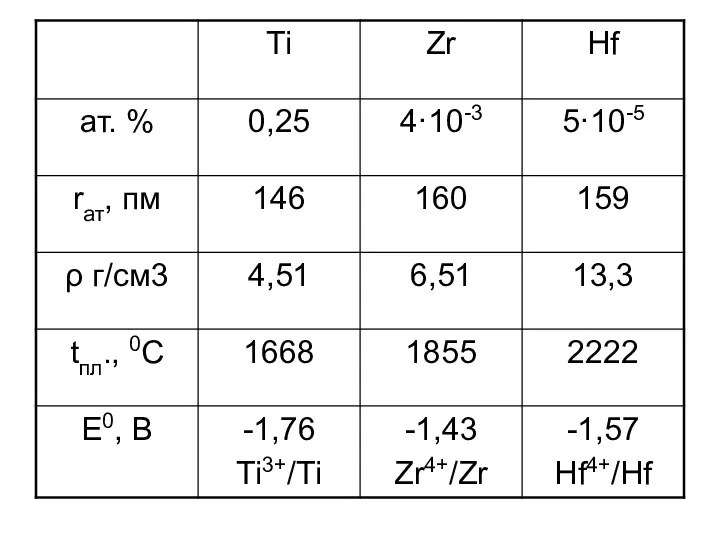
Содержание
- 3. TiO2 - рутил СaTiO3 - перовскіт FeTiO3 - ільменіт FeTiO3·4Fe3O4 - титаномагнетит ZrO2 - бадалеїт ZrSiO4
- 4. Добування FeTiO3 → TiOSO4 → TiO2·xH2O → TiO2 TiO2 + 2C + 2Cl2 → TiCl4 +
- 5. ZrSiO4 + K2[SiF6] → K2[ZrF6] + SiO2 ZrSiO4 + 4C → ZrC + SiO↑ + CO↑
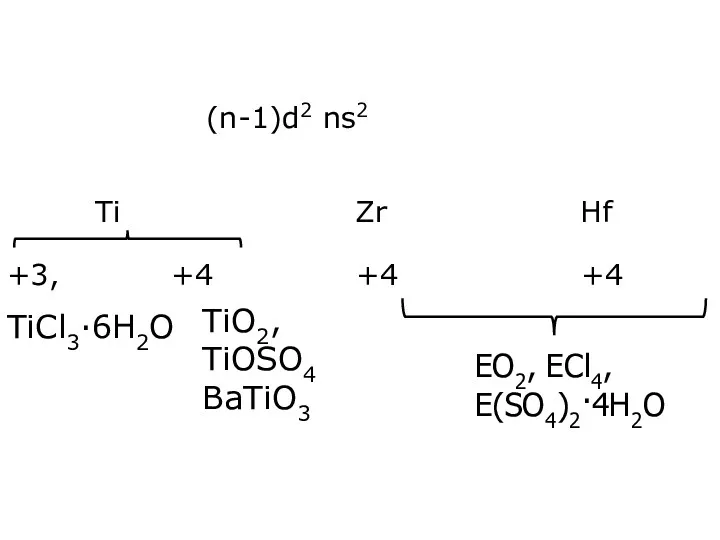
- 6. (n-1)d2 ns2 Ti Zr Hf +3, +4 +4 +4 TiCl3·6H2O TiO2, TiOSO4 BaTiO3 EO2, ECl4, E(SO4)2·4H2O
- 7. Хімічні властивості Ti, Zr, Hf вкриті тонкими, хімічно стійкими плівками оксидів ЕО2, що забезпечують хімічну інертність
- 8. Zr + 4HF → ZrF4 + 2H2↑ Zr + 6HF → H2[ZrF6] + 2H2↑ 3Me +
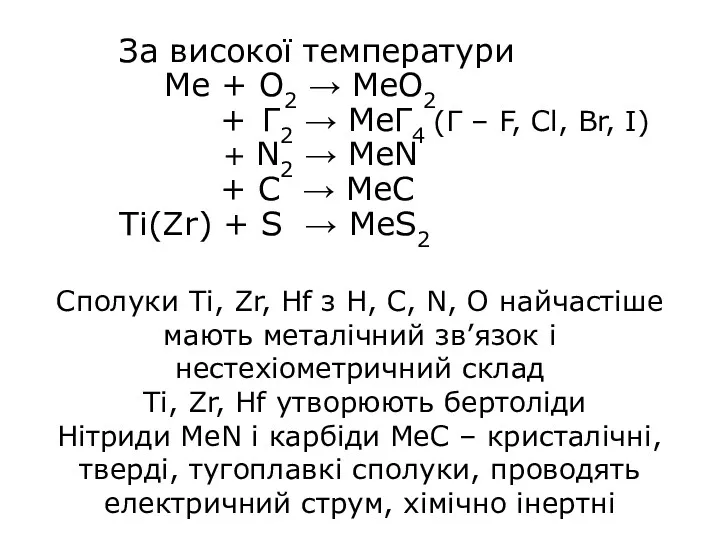
- 9. За високої температури Me + O2 → MeO2 + Г2 → MeГ4 (Г – F, Cl,
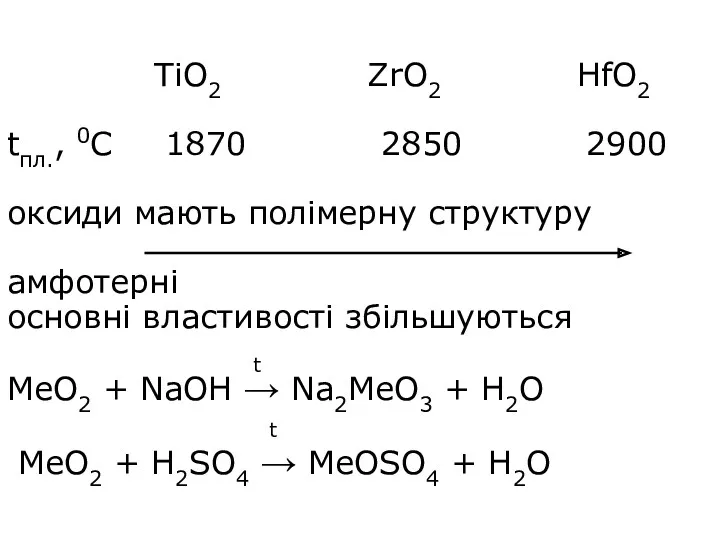
- 10. TiO2 ZrO2 HfO2 tпл., 0С 1870 2850 2900 оксиди мають полімерну структуру амфотерні основні властивості збільшуються
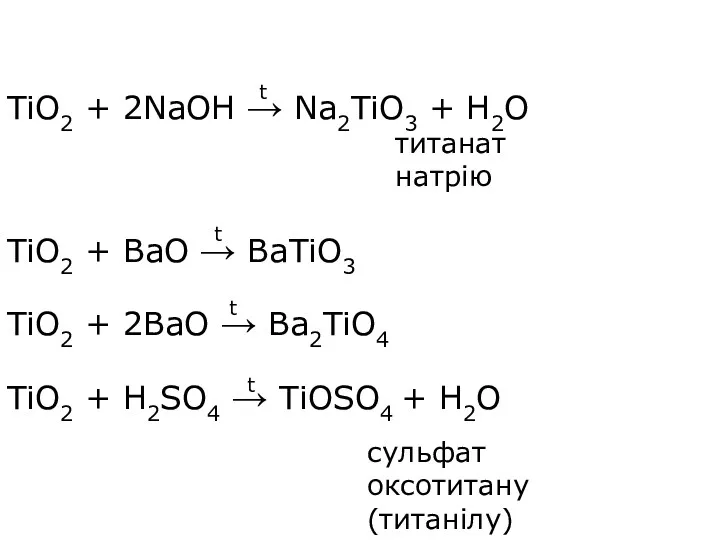
- 11. TiO2 + 2NaOH → Na2TiO3 + H2O TiO2 + BaO → BaTiO3 TiO2 + 2BaO →
- 12. Титанати лужноземельних металів у воді не розчинні, а титанати лужних металів повністю гідролізують Na2TiO3 + nH2O
- 13. α – титанова кислота TiO(OH)2 або H2TiO3 β – титанова кислота (TiO2)x·(H2O)y В процесі “старіння” α
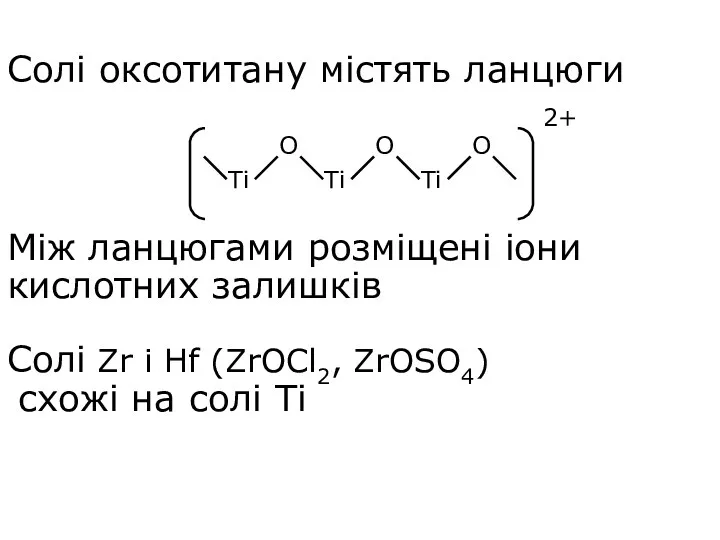
- 14. Солі оксотитану містять ланцюги Між ланцюгами розміщені іони кислотних залишків Солі Zr і Hf (ZrOCl2, ZrOSO4)
- 15. Всі ЕГ4 у розчинах сильно гідролізують TiCl4 → TiOCl2 ⇆ TiO(OH)2 TiCl4 + H2O → TiOCl2
- 16. TiO + 2H+ +1e ⇆ Ti + H2O E0 = 0,1 В 2TiOCl2 + Zn +
- 17. Сполуки Ті+3 – сильні відновники 4ТiCl3 + O2 + 2H2O → 4TiOCl2 + 4HCl Розчин TiCl3
- 18. Застосування Ti - важливий конструкційний матеріал Ti і його cплави відрізняються високою міцністю, легкістю, тугоплавкістю, хімічною
- 19. TiC - тверді сплави TiB2 - деталі турбін, ракет ВаТіО3 – для виготовлення електричних конденсаторів TiCl3
- 21. Скачать презентацию


![ZrSiO4 + K2[SiF6] → K2[ZrF6] + SiO2 ZrSiO4 + 4C](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/595123/slide-4.jpg)

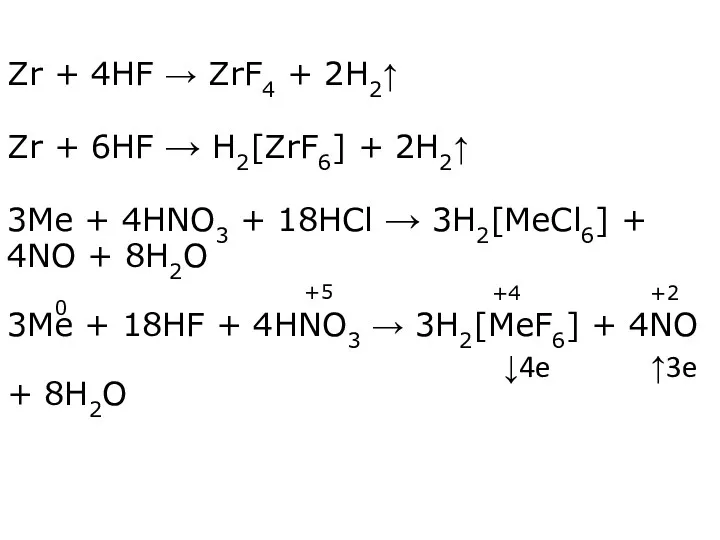



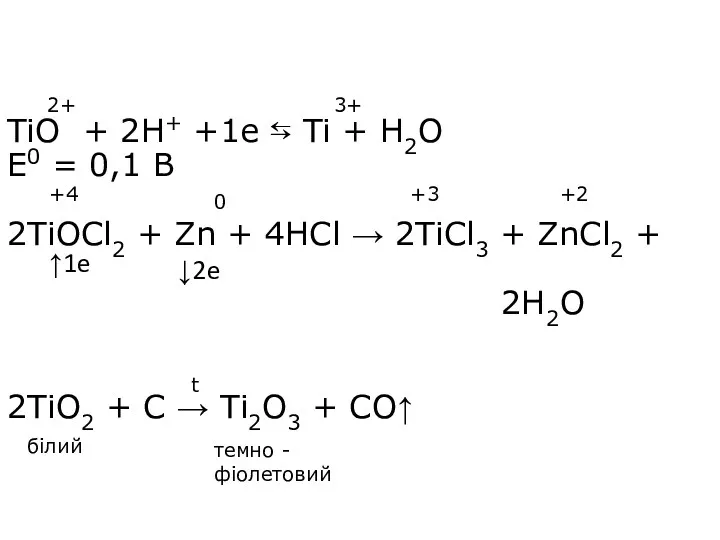



 III А – топтың элементтері
III А – топтың элементтері Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Классификация химических элементов. 8 класс
Классификация химических элементов. 8 класс Органічні сполуки і здоров’я людини. Жири, білки, вуглеводи, вітаміни як компоненти їжі, їх роль в організмі
Органічні сполуки і здоров’я людини. Жири, білки, вуглеводи, вітаміни як компоненти їжі, їх роль в організмі Коррозия и защита полимерных строительных материалов
Коррозия и защита полимерных строительных материалов Химический состав и пищевая ценность продовольственных товаров
Химический состав и пищевая ценность продовольственных товаров Изучение и развитие понятия химический элемент в школьном курсе химии
Изучение и развитие понятия химический элемент в школьном курсе химии Полимеры органические и неорганические
Полимеры органические и неорганические Коррозия материалов
Коррозия материалов Обмен липидов
Обмен липидов Химия и сельское хозяйство
Химия и сельское хозяйство Химия и здоровье
Химия и здоровье Оксиды (1 этап изучения). 8 класс
Оксиды (1 этап изучения). 8 класс Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Електеу дегеніміз
Електеу дегеніміз Электролитическая диссоциация. Ионные реакции
Электролитическая диссоциация. Ионные реакции Химическая взрывчатка
Химическая взрывчатка 20231114_soli._klassifikatsiyasvoystva
20231114_soli._klassifikatsiyasvoystva Валентность и степень окисления 8 класс
Валентность и степень окисления 8 класс Алкины
Алкины Азот
Азот Приборы и методы исследования в химической технологии
Приборы и методы исследования в химической технологии Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Полимеры. Волокна
Полимеры. Волокна Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева
Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева Нефть и газ
Нефть и газ Занимательные опыты
Занимательные опыты Д. И. Менделеев человек - загадка
Д. И. Менделеев человек - загадка