Содержание
- 2. Во второй половине XVIII в. внимание сразу нескольких ученых привлек газ, остающийся при сжигании в воздухе
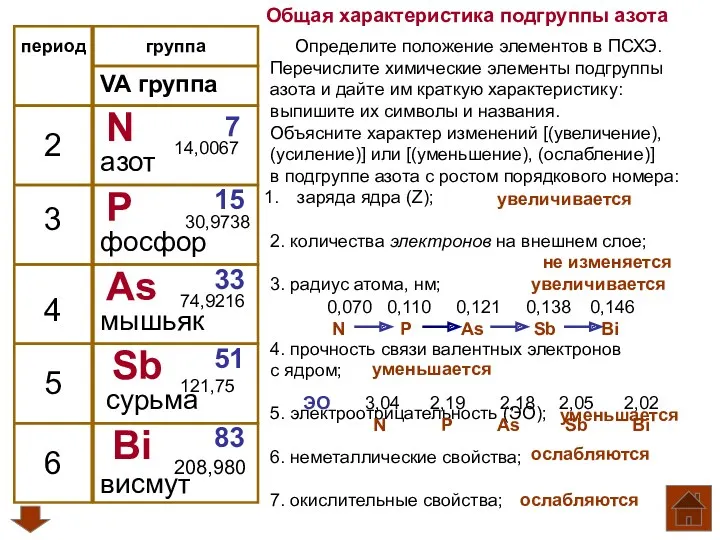
- 3. период VA группа 2 3 4 5 N P As Sb Bi 7 15 33 51
- 4. группа 3 4 5 6 V A группа N P As Sb Bi 2 7 +7
- 5. III. Азот – химический элемент Положение азота в ПСХЭ Д.И.Менделеева Строение атома 3. Нахождение в природе
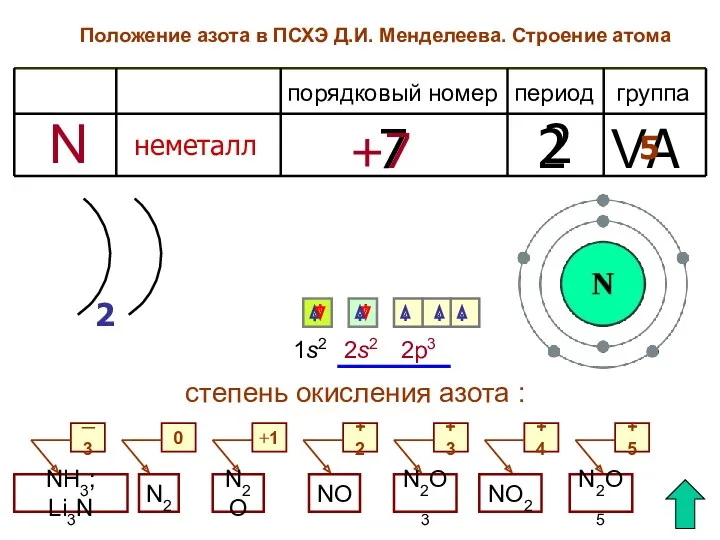
- 6. Положение азота в ПСХЭ Д.И. Менделеева. Строение атома период группа порядковый номер неметалл 7 2 VA
- 7. Нахождение в природе Азотсодержащие минералы редки. Большие залежи чилийской селитры NaNO3 имеются лишь в высокогорной пустыне
- 8. IV. Азот – простое вещество 1. Состав. Строение. Свойства 3. Химические свойства азота 4. Применение азота
- 9. Состав. Строение. Свойства N + N N N Химическая связь: ковалентная неполярная Кристаллическая решетка: молекулярная Заполните
- 10. Получение азота В лаборатории азот получают разложением нитрита аммония. Составьте уравнение реакции. В промышленности азот получают
- 11. Разложение нитрита аммония NH4NO 2 N2 + 2H2O t
- 12. Разложение бихромата аммония (NH4)2Cr2O7 = Cr2O3 + N2 + H2O
- 13. Химические свойства Взаимодействие с простыми веществами: с неметаллами Реакция азота с кислородом начинается лишь в электрическом
- 14. Реакция синтеза аммиака: 1. реакция соединения, т.к. из двух веществ образовалось одно вещество; 2. окислительно-восстановительной; 3.
- 15. Условиями смещения химического равновесия в сторону образования аммиака является: 1) понижение температуры (т.к. реакция экзотермическая); 2)
- 16. с металлами Взаимодействие азота с активными металлами приводит к образованию нитридов. Азот реагирует с активными металлами
- 17. Определите тип химической связи в соединениях азота с металлами. Спрогнозируйте физические свойства этих соединений. В нитридах
- 18. Взаимодействие азота со сложными веществами 1) Взаимодействие азота с карбидом кальция, в результате образуется цианамид кальция:
- 19. Применение азота 1) для получение аммиака; Азот применяют: 2) при сварке металлов;
- 20. 3) в медицине; 5) в вакуумных установках; 4) как инертную химических и металлургических процессах;
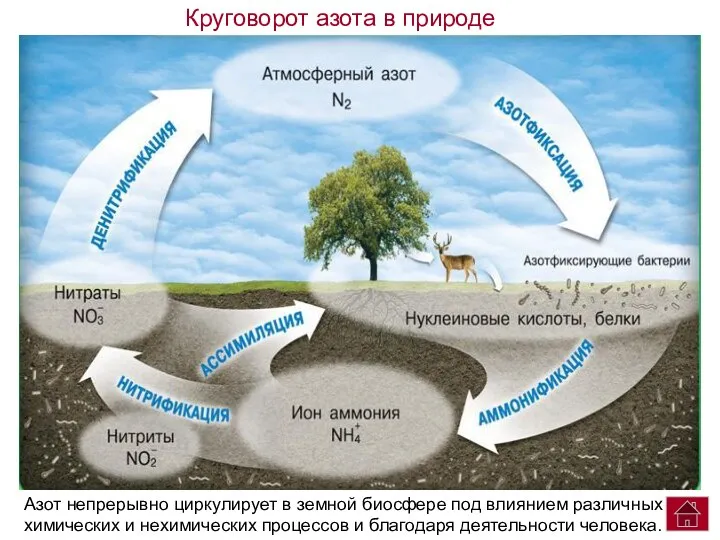
- 21. Азот непрерывно циркулирует в земной биосфере под влиянием различных химических и нехимических процессов и благодаря деятельности
- 22. Круговорот азота представляет собой ряд замкнутых взаимосвязанных путей, по которым азот циркулирует в земной биосфере. Рассмотрим
- 24. Скачать презентацию


















 Элементы VА-группы
Элементы VА-группы Кристаллы. Формы
Кристаллы. Формы Розв’язування задач на приготування розчинів із кристалогідратів
Розв’язування задач на приготування розчинів із кристалогідратів Вуглеводи
Вуглеводи Составление уравнений химических реакций
Составление уравнений химических реакций Липиды растений и их обмен
Липиды растений и их обмен Основы кристаллического строения металлов
Основы кристаллического строения металлов Получение и приминение этилена
Получение и приминение этилена Проектная работа. Косметика своими руками
Проектная работа. Косметика своими руками Адсорбция. Физическая и химическая адсорбция
Адсорбция. Физическая и химическая адсорбция Элементарные частицы вещества
Элементарные частицы вещества Закон сохранения массы вещества. Химические уравнения
Закон сохранения массы вещества. Химические уравнения Кислоты и их свойства
Кислоты и их свойства Лекарственные средства, производные пиридина и пиперазина
Лекарственные средства, производные пиридина и пиперазина Коррозия металлов и способы ее устранения
Коррозия металлов и способы ее устранения Нефть и способы её переработки
Нефть и способы её переработки Функціональні матеріали для високоенергетичної електроніки. (Лекція 1)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 1) Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Основы органической химии
Основы органической химии Молекулярная кулинария
Молекулярная кулинария Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Решение задачи №10. Гидроксид рубидия. Команда Карбораны
Решение задачи №10. Гидроксид рубидия. Команда Карбораны Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Генетическая связь между основными классами неорганических веществ
Генетическая связь между основными классами неорганических веществ Органічні розчинники. 11 клас
Органічні розчинники. 11 клас Композиционные материалы для изоляции электрических машин
Композиционные материалы для изоляции электрических машин Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация
Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация Строение и свойства аминокислот и белков
Строение и свойства аминокислот и белков