С неметаллами
C + O2 → CO2
S + O2 → SO2
2H2 +
O2 → 2H2O
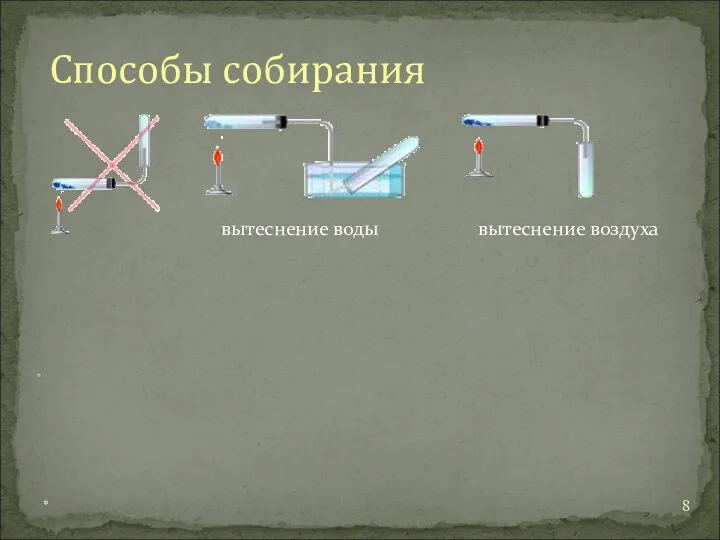
*
5
Химические свойства
Со сложными веществами
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2H2S + 3O2 → 2SO2 + 2H2O
CH4 + 2O2 → CO2 + 2H2O
С металлами
2Mg + O2 → 2MgO
2Cu + O2 –t°→ 2CuO
Взаимодействие веществ с кислородом называется окислением.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород - окислитель.
1. Неустойчив: O3 → O2 + O
2. Сильный окислитель: 2KI + O3 + H2O → 2KOH + I2 + O2
Обесцвечивает красящие вещества, отражает УФ - лучи, уничтожает микроорганизмы.






 Общая характеристика углеводов: глюкоза
Общая характеристика углеводов: глюкоза Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации Закон сохранения массы веществ
Закон сохранения массы веществ Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Методы определения поверхностной энергии твердых тел. Контроль растекания, смачивания, адгезии и водостойкости покрытий
Методы определения поверхностной энергии твердых тел. Контроль растекания, смачивания, адгезии и водостойкости покрытий Основное уравнение молекулярно-кинетической теории. Идеальный газ
Основное уравнение молекулярно-кинетической теории. Идеальный газ Күкірт қышқылы
Күкірт қышқылы Интересные факты о химических веществах
Интересные факты о химических веществах Химическая термодинамика
Химическая термодинамика Введение в кристаллографию
Введение в кристаллографию Оксиды. Химические свойства и получение оксидов
Оксиды. Химические свойства и получение оксидов Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері
Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері Приемы обращения с лабораторным оборудованием. Строение пламени
Приемы обращения с лабораторным оборудованием. Строение пламени Пластмасса, пластикалық материалдар
Пластмасса, пластикалық материалдар Предмет и задачи химии. Место химии среди естественных наук. Атомно-молекулярное учение. Основные стехиометрические законы химии
Предмет и задачи химии. Место химии среди естественных наук. Атомно-молекулярное учение. Основные стехиометрические законы химии Использование сплавов алюминия
Использование сплавов алюминия Щелочные металлы
Щелочные металлы Липиды. Составные части липидов
Липиды. Составные части липидов Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Йони. Йонний зв’язок, його утворення
Йони. Йонний зв’язок, його утворення Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії
Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії Вводная лекция
Вводная лекция Вещества и их превращения Роль химии в нашей жизни
Вещества и их превращения Роль химии в нашей жизни Stirring in liquid media
Stirring in liquid media Молекулы и атомы. Броуновское движение
Молекулы и атомы. Броуновское движение соединения VI группы продвинутая версия
соединения VI группы продвинутая версия