Содержание
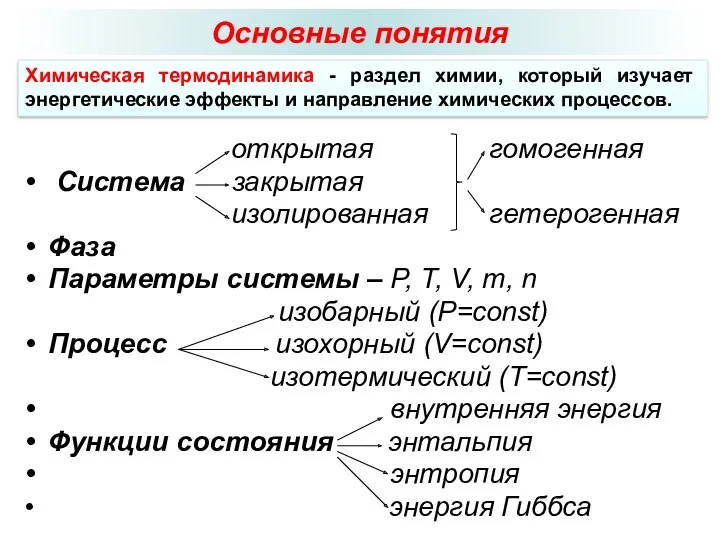
- 2. Основные понятия открытая гомогенная Система закрытая изолированная гетерогенная Фаза Параметры системы – Р, Т, V, m,
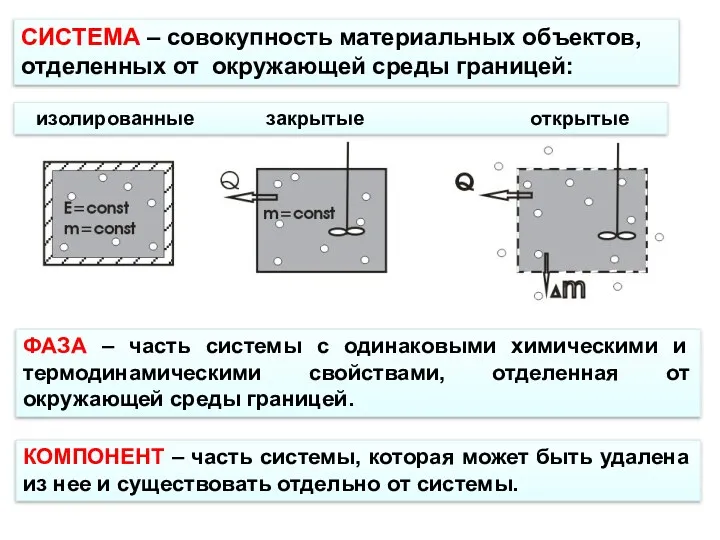
- 3. СИСТЕМА – совокупность материальных объектов, отделенных от окружающей среды границей: изолированные закрытые открытые ФАЗА – часть
- 4. Первый закон термодинамики Количество теплоты (Q) поглощенное системой, расходуется на увеличение внутренней энергии системы (ΔU) и
- 5. Внутренняя энергия системы (U) - представляет собой ее полную энергию, которая складывается из кинетической и потенциальной
- 6. Термохимические уравнения реакций: Н2(г) + ½ О2(г) = Н2О(г) , ΔН = -242 кДж. Q= -ΔН,
- 7. При экзотермическом процессе Q > 0, ΔН при эндотермическом Q 0 ΔН – теплосодержание системы энтальпия
- 8. Закон Гесса: Тепловой эффект химической реакции, проходящей либо при постоянном объеме, либо при постоянном давлении, не
- 9. Энтальпия образования (ΔН) - тепловой эффект реакции образования 1 моль соединения из простых веществ, находящихся в
- 10. Стандартные условия: температура 25 оС (298,15 К) и давление 101 325 Па (1 атм или 760
- 11. Следствие из закона Гесса: Тепловой эффект реакции (ΔН°р-ции) равен сумме энтальпий образования продуктов реакции (ΔHfопрод )
- 12. НАПРИМЕР: Al2O3(к.) + 3SO3(г.) → Al2(SO4)3(к.) ΔH°298 -1676,0 -395,8 -3442,2 кДж/моль РЕШЕНИЕ: ΔH = ΔHAl2(SO4)3 –
- 13. Второй закон термодинамики: В изолированных системах самопроизвольно протекают реакции, сопровождающиеся увеличением энтропии. (ΔSизолир > 0) реакция
- 14. Для вычисления ΔSор-ции можно применить закон Гесса: ΔSор-ции = ∑ni ΔSопрод - ∑nj ΔSоисх ni и
- 15. 1850г., Клаузиус, энтропия – для характеристики потерянной тепловой энергии при работе теплового двигателя. ΔS=ΔQ/Т –для равновесного
- 16. Энтропия как мера неупорядоченности в системе Увеличение энтропии связано с усилением хаотического движения молекул, атомов и
- 17. Энергия Гиббса (ΔG ) – критерий самопроизвольного протекания процесса в НЕизолированной системе: ΔG=ΔH - T⋅ΔS Вычисление
- 18. ΔG ΔG>0 – реакция невозможна ΔG=0 – состояние термодинамического равновесия Свободная энергия, энергия Гиббса, изобарно-изотермический потенциал
- 19. ΔG = ΔH - T⋅ΔS ΔH - энтальпийный фактор T⋅ΔS - энтропийный фактор Если ΔH>0 и
- 21. Скачать презентацию
















 Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие
Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие Белки. Аминокислоты
Белки. Аминокислоты Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів
Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів Арени. Бензен: молекулярна і структурна формули, фізичні властивості
Арени. Бензен: молекулярна і структурна формули, фізичні властивості Functions of proteins
Functions of proteins Мытье головы
Мытье головы кл.химия 24.01
кл.химия 24.01 Полимеры и пластические массы
Полимеры и пластические массы Естери. Класифікація та номенклатура естерів
Естери. Класифікація та номенклатура естерів Литий. Физические и химические свойства. Получение и применение
Литий. Физические и химические свойства. Получение и применение О каком веществе речь?
О каком веществе речь? Углеводороды. Алканы
Углеводороды. Алканы Строение электронных оболочек атомов
Строение электронных оболочек атомов Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Обратимость химических реакций. Химическое равновесие и способы его смещения
Обратимость химических реакций. Химическое равновесие и способы его смещения Основной государственный экзамен Химия 2021. Задание 5
Основной государственный экзамен Химия 2021. Задание 5 Валентность химического элемента. Определение валентности по химической формуле
Валентность химического элемента. Определение валентности по химической формуле Закон постоянства состава. Молекулярная формула вещества
Закон постоянства состава. Молекулярная формула вещества Каучук туралы жалпы мәліметтер
Каучук туралы жалпы мәліметтер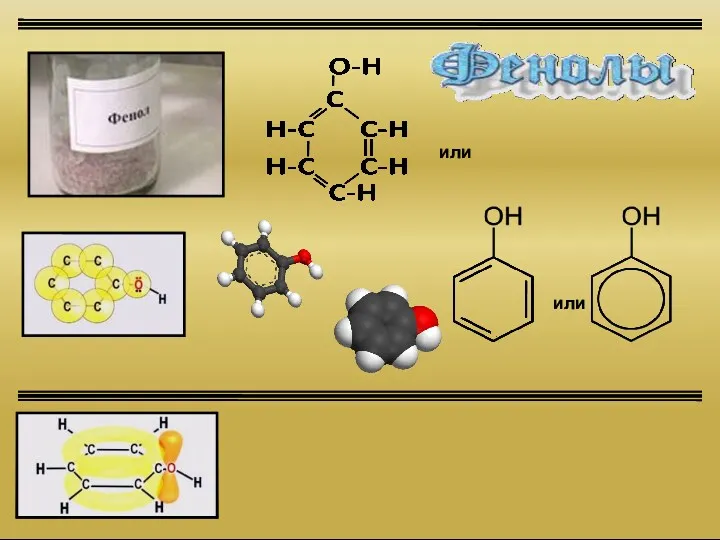 Фенолы
Фенолы Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины
Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины Переработка нефти. Крекинг
Переработка нефти. Крекинг Химический элемент. Электронное строение атома
Химический элемент. Электронное строение атома Физические и химические свойства алкенов
Физические и химические свойства алкенов Rhodium
Rhodium Геохимические барьеры
Геохимические барьеры Аммиак. 9 класс
Аммиак. 9 класс Спирти
Спирти