Содержание
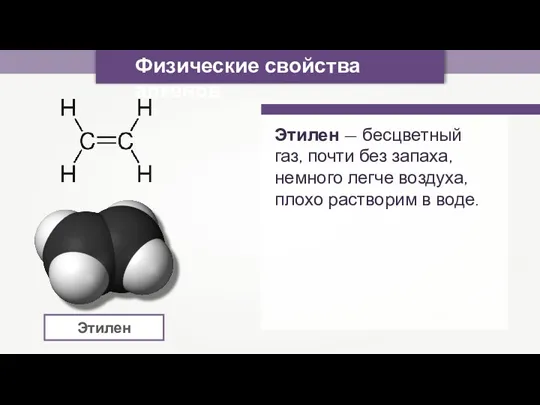
- 2. Физические свойства алкенов Этилен — бесцветный газ, почти без запаха, немного легче воздуха, плохо растворим в
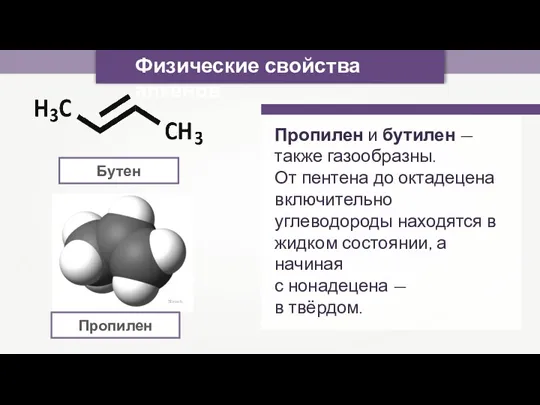
- 3. Sbrools Пропилен Физические свойства алкенов Бутен Пропилен и бутилен — также газообразны. От пентена до октадецена
- 4. Алкены плохо растворимы в воде, но хорошо — в органических растворителях. Этилен и пропилен горят коптящим
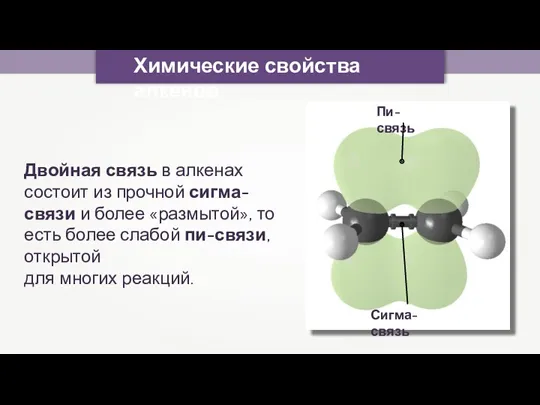
- 5. Химические свойства алкенов Двойная связь в алкенах состоит из прочной сигма-связи и более «размытой», то есть
- 6. Кратная связь представляет собой область повышенной электронной плотности, которая доступна для частиц с полным или частичным
- 7. Реакции присоединения Реакция гидрирования (гидрогенизация) — это реакция взаимодействия с водородом, которая происходит в присутствии катализатора
- 8. Реакции присоединения Алкены вступают в реакцию галогенирования — это реакция взаимодействия с галогенами. CnH2n + Г2
- 9. Периодическая система химических элементов Дмитрия Ивановича Менделеева
- 10. Качественной реакцией для алкенов является обесцвечивание бромной воды, которая изначально имеет бурое окрашивание. СH2 = CH2
- 11. Реакции присоединения Реакция гидрогалогенирование — это реакция взаимодействия с галогенводородами. R—CH = CH2 + НГ →
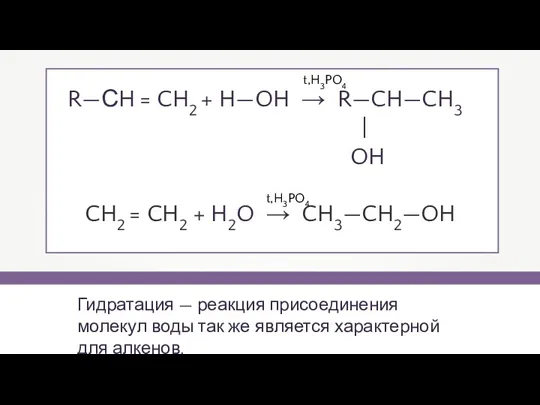
- 12. Гидратация — реакция присоединения молекул воды так же является характерной для алкенов. R—СH = CH2 +
- 13. Марковников Владимир Васильевич 1803–1873 гг. Присоединение галогенводородов и воды к несимметричным алкенам происходит по правилу Марковникова
- 14. Ещё одной характерной реакцией для алкенов и для всех органических соединений является реакция окисления.
- 15. Реакция горения — разновидность быстропротекающей реакции окисления. CnH2n +3n : 2O2 → nCO2 + nH2O +
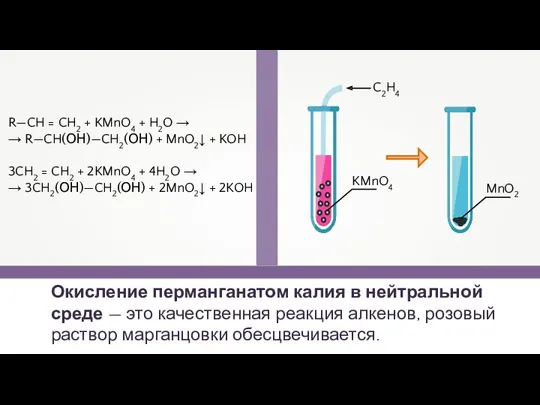
- 16. Окисление перманганатом калия в нейтральной среде — это качественная реакция алкенов, розовый раствор марганцовки обесцвечивается. R—CH
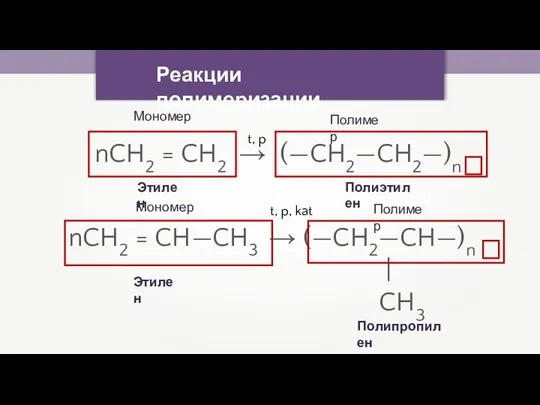
- 17. Реакции полимеризации nCH2 = CH2 → (—CH2—CH2—)n t, p nCH2 = CH—CH3 → (—CH2—CH—)n | CH3
- 18. Реакция полимеризации — процесс последовательного соединения одинаковых молекул в большие по размерам молекулы.
- 19. Этиленовые углеводороды с воздухом образуют небезопасные взрывные смеси, про это надо помнить во время работы с
- 21. Скачать презентацию










 Чисті речовини і суміші
Чисті речовини і суміші Oxygen, O2
Oxygen, O2 Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін)
Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін) В мире криссталлов
В мире криссталлов Д. И. Менделеев человек - загадка
Д. И. Менделеев человек - загадка Классификация органических соединений
Классификация органических соединений Классификация дисперсных систем
Классификация дисперсных систем Ароматические азотсодержащие соединения
Ароматические азотсодержащие соединения Железо и его соединения
Железо и его соединения Аминокислоты, их строение, изомерия, свойства, применение
Аминокислоты, их строение, изомерия, свойства, применение Галогены
Галогены Природные источники углеводородов
Природные источники углеводородов Виды химической связи
Виды химической связи Методы окислительно-восстановительного титрования (Редоксиметрия)
Методы окислительно-восстановительного титрования (Редоксиметрия) Закон сохранения массы веществ
Закон сохранения массы веществ Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода
Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода Электрохимическая защита
Электрохимическая защита Соединения кремния
Соединения кремния Катионная полимеризация (Лекция 6)
Катионная полимеризация (Лекция 6) Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі
Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі Алкадиены
Алкадиены Геометрическая кристаллография
Геометрическая кристаллография Закономерности управления каталитическими процессами
Закономерности управления каталитическими процессами Бензин. Физико-химические свойства бензина
Бензин. Физико-химические свойства бензина Ионные уравнения
Ионные уравнения Йод в нашей жизни
Йод в нашей жизни Кислородные соединения серы. Серная кислота
Кислородные соединения серы. Серная кислота Понятие биогенности химических элементов
Понятие биогенности химических элементов