Содержание
- 2. Вид занятия: Лекция Цель: сформировать у студентов знания о железе и его соединениях; изучить общую характеристику
- 3. Вопросы: Характеристика железа, согласно положению в ПСЭ Д. И. Менделеева. Получение. Физические и химические свойства. Соединения
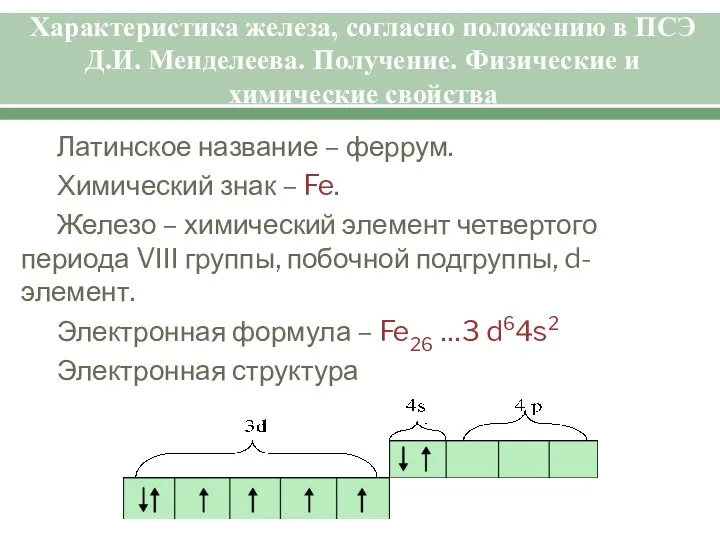
- 4. Характеристика железа, согласно положению в ПСЭ Д.И. Менделеева. Получение. Физические и химические свойства Латинское название –
- 5. Характеристика железа, согласно положению в ПСЭ Д.И. Менделеева. Получение. Физические и химические свойства Из электронной формулы
- 6. Характеристика железа, согласно положению в ПСЭ Д.И. Менделеева. Получение. Физические и химические свойства Их залежи находятся
- 7. Получение железа Особо чистое железо получают из оксида железа(ΙΙΙ), восстановление его водородом. 700°C Fe2O3 + 3
- 8. Получение железа В промышленности железо получают восстановлением оксидных руд в доменных печах, в присутствии кокса и
- 9. Физические свойства Блестящий, серебристо-белый тяжелый металл. Легко подвергается ковке, прокатке и другим видам обработки, как в
- 10. Химические свойства Железо относится к достаточно активным Ме, со средней восстановительной активностью. В ряду напряжений стоит
- 11. Химические свойства Отношение железа к простым веществам 2. В обычных условиях железо медленно окисляется, быстро сгорает
- 12. Химические свойства Отношение железа к сложным веществам 4. При высокой температуре железо реагирует с парами воды:
- 13. Химические свойства Отношение железа к сложным веществам 5. Концентрированная серная и азотная кислоты при нормальных условиях
- 14. Соединения железа(ΙΙ), железа(ΙΙΙ). Получение. Свойства Для железа одинаково характерны степени окисления +2 и +3. Поэтому оно
- 15. Соединения железа(ΙΙ), железа(ΙΙΙ). Получение. Свойства
- 16. Соединения железа(ΙΙ), железа(ΙΙΙ). Получение. Свойства
- 17. Соединения железа(ΙΙ), железа(ΙΙΙ). Получение. Свойства Так как железо принадлежит к элементам с переменной валентностью, поэтому его
- 18. Соединения железа(ΙΙ), железа(ΙΙΙ). Получение. Свойства
- 19. Соединения железа(ΙΙ), железа(ΙΙΙ). Получение. Свойства
- 20. Биологическая роль и применение в медицине препаратов железа Ионы железа входят в состав каждой клетки тела
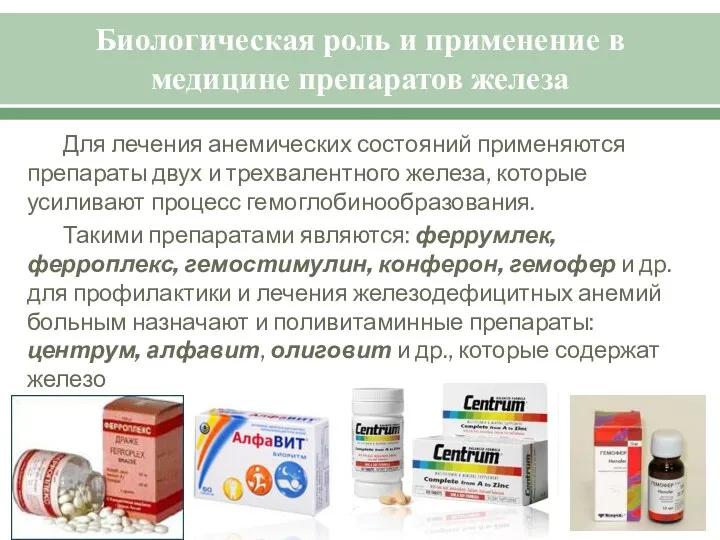
- 21. Биологическая роль и применение в медицине препаратов железа Для лечения анемических состояний применяются препараты двух и
- 23. Скачать презентацию


















 Валентность и степень окисления
Валентность и степень окисления Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Фазовые превращения в стали при охлаждении
Фазовые превращения в стали при охлаждении Строение вещества. Химические элементы
Строение вещества. Химические элементы Геохимия стабильных изотопов, Радиоуглеродный метод
Геохимия стабильных изотопов, Радиоуглеродный метод Побочная подгруппа 6 и 7 групп
Побочная подгруппа 6 и 7 групп Химическая связь
Химическая связь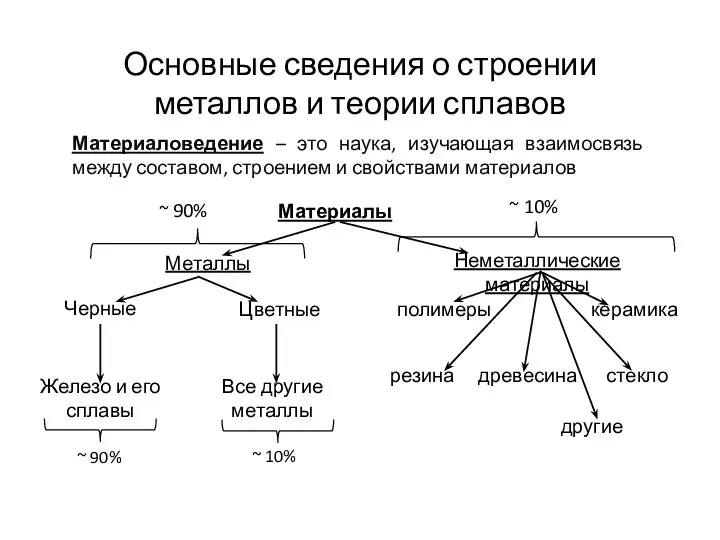 Основные сведения о строении металлов и теории сплавов
Основные сведения о строении металлов и теории сплавов Углеводы. Моносахариды
Углеводы. Моносахариды Виды химических реакций
Виды химических реакций Separation amp confirmation
Separation amp confirmation Карбонаты
Карбонаты Hydrochloric acid HCl
Hydrochloric acid HCl Алкены. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция 3
Алкены. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция 3 Metode electrochimice. Generalităţi
Metode electrochimice. Generalităţi Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром
Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром Оксид фосфора P2O5
Оксид фосфора P2O5 Химическая связь в твердых веществах и жидкостях
Химическая связь в твердых веществах и жидкостях Гидрохимические определения. Методы определения растворенного кислорода в воде
Гидрохимические определения. Методы определения растворенного кислорода в воде Углеводы. (Лекция 7)
Углеводы. (Лекция 7) Описание основных типов магматических горных пород
Описание основных типов магматических горных пород Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза
Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза Классы неорганических веществ. Лекция №2
Классы неорганических веществ. Лекция №2 Строение атома. Периодический закон Менделеева
Строение атома. Периодический закон Менделеева Характеристика химических элементов и химических реакций
Характеристика химических элементов и химических реакций Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Чистые вещества и смеси
Чистые вещества и смеси