Содержание
- 2. Углеводы – класс природных кислородсодержащих органических соединений, состав которых обычно соответствует эмпирической формуле Сn(H2O)m (т.е. углерод
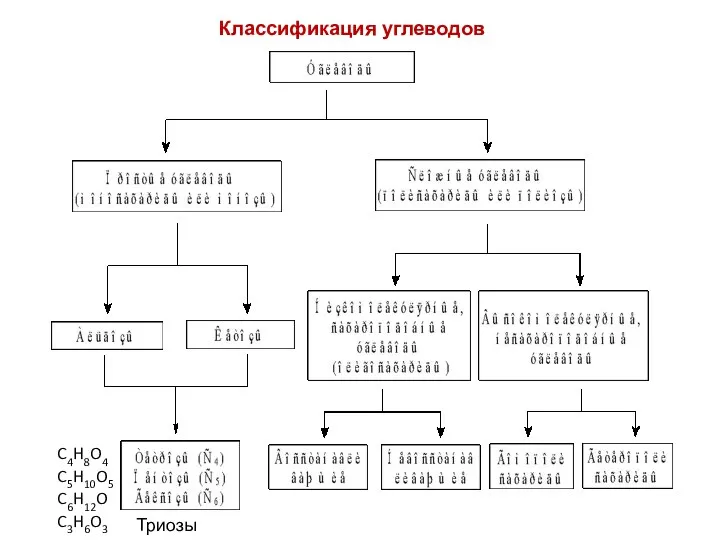
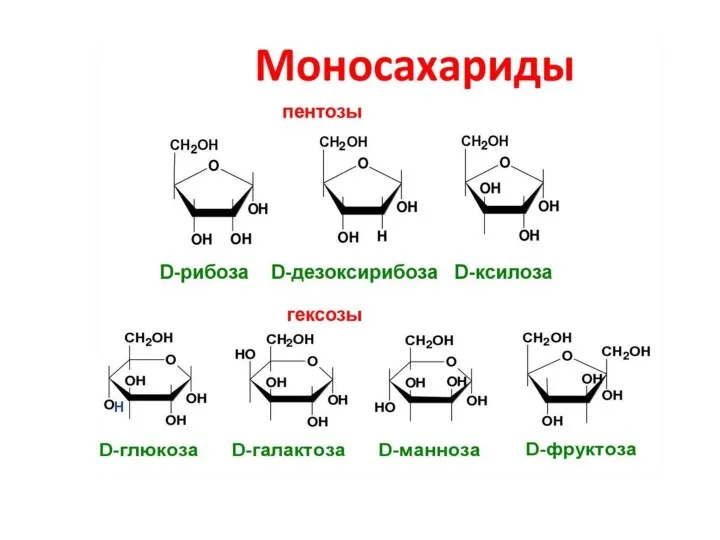
- 3. Классификация углеводов C4H8O4 C5H10O5 C6H12O Триозы (С3) C3H6O3
- 4. Среди моносахаридов наиболее распространены полиоксиальдегиды (альдозы) и полиоксикетоны (кетозы). К моносахаридам также относят их производные, содержащие
- 5. В качестве конфигурационного стандарта используют глицериновый альдегид. Стероизомерия углеводов Общее число оптических изомеров : N =
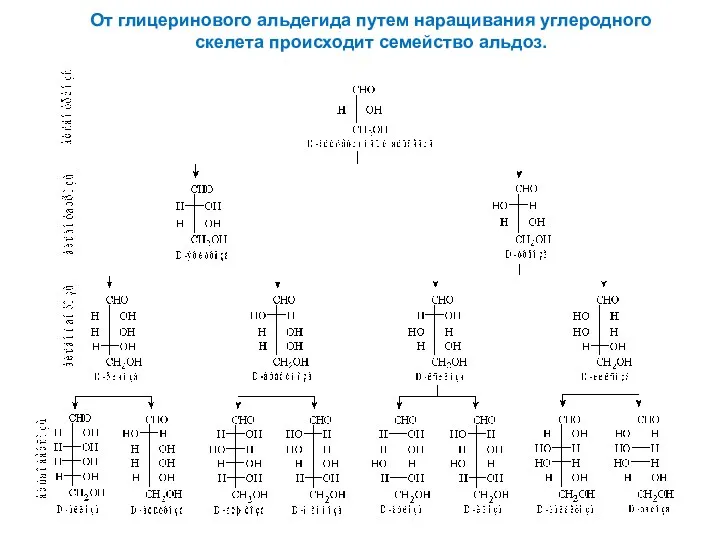
- 6. От глицеринового альдегида путем наращивания углеродного скелета происходит семейство альдоз.
- 7. Среди оптических изомеров различают: 1) Энантиомеры − пространственные изомеры, молекулы которых являются несовместимыми зеркальными антиподами. Энантиомеры
- 8. 2) Эпимеры − пространственные изомеры, молекулы которых различаются конфигурацией заместителей у одного асимметрического атома углерода. Эпимеры
- 9. 3) Диастереомеры − пространственные изомеры, молекулы которых различаются конфигурацией заместителей у двух и более асимметрических атомов
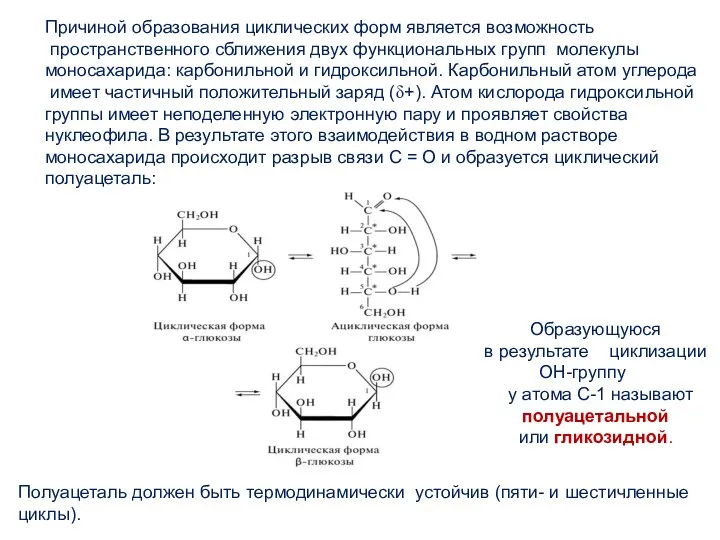
- 10. Истинное строение моносахаридов не отражается открытыми формулами, так как они являются таутомерными смесями открытой и циклической
- 11. Причиной образования циклических форм является возможность пространственного сближения двух функциональных групп молекулы моносахарида: карбонильной и гидроксильной.
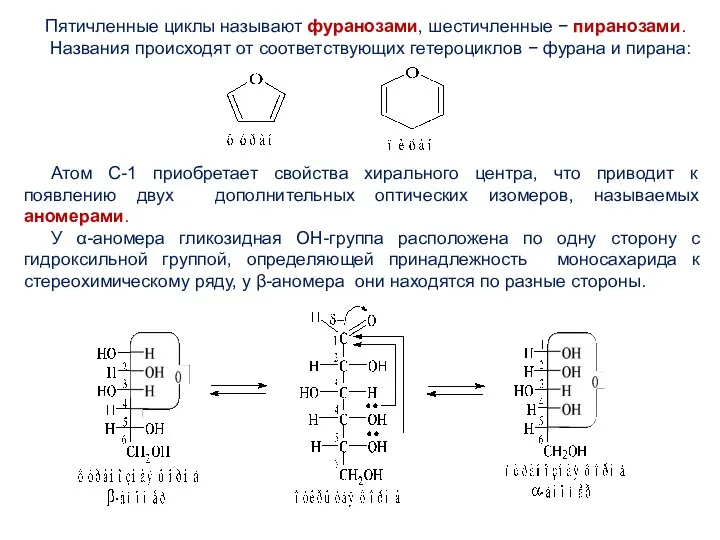
- 12. Пятичленные циклы называют фуранозами, шестичленные − пиранозами. Названия происходят от соответствующих гетероциклов − фурана и пирана:
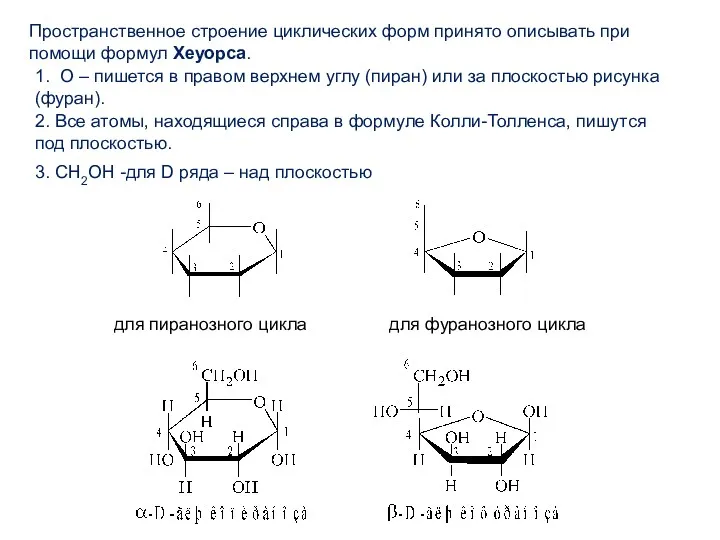
- 13. Пространственное строение циклических форм принято описывать при помощи формул Хеуорса. 1. О – пишется в правом
- 14. Названия циклических форм строятся следующим образом: * сначала указывают положение полуацетального гидроксила (α- или β-), *
- 15. В целом, пиранозные циклы более устойчивы, чем фуранозные, а в полярных растворителях более устойчивы β-аномеры благодаря
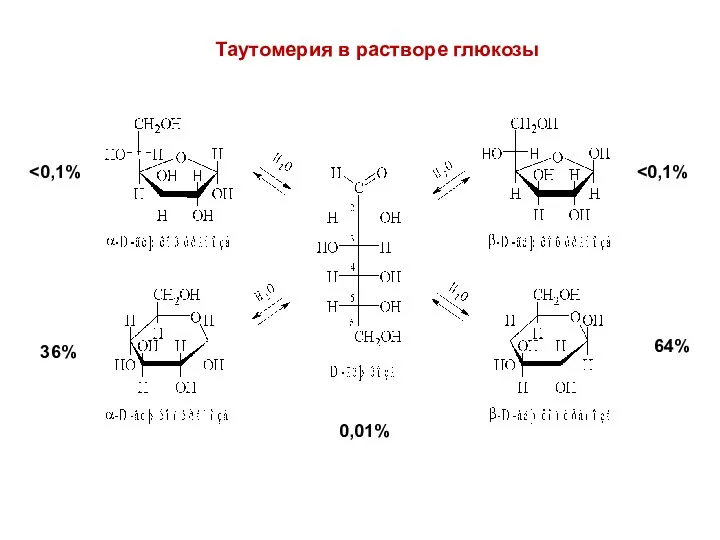
- 17. 64% 36% 0,01% Таутомерия в растворе глюкозы
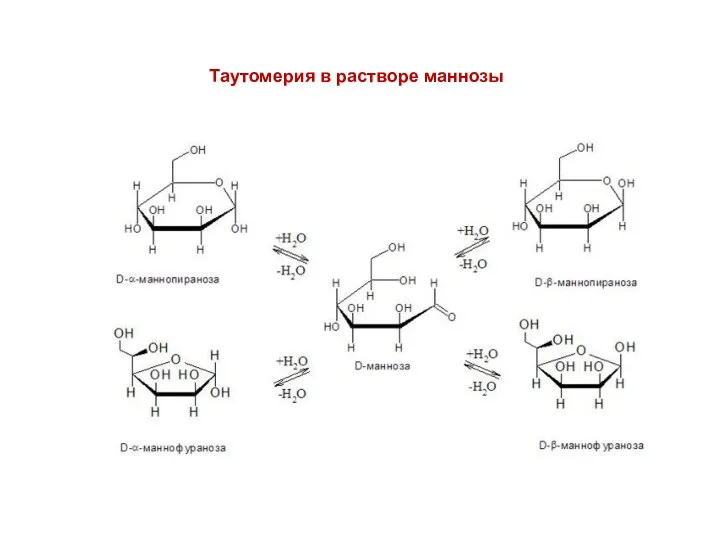
- 18. Таутомерия в растворе маннозы
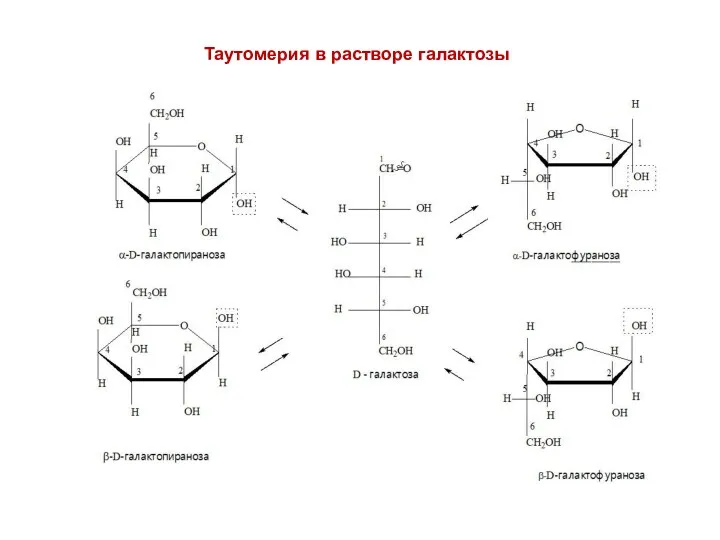
- 19. Таутомерия в растворе галактозы
- 20. Таутомерия в растворе фруктозы
- 21. 1. Образование простых эфиров Если через раствор D-глюкозы в метаноле пропустить газообразный HCl, то в результате
- 22. Нуклеофильной атаке подвергается атом С-1, который является хиральным центром. В отсутствии специфических условий протекания реакции (н.р.,
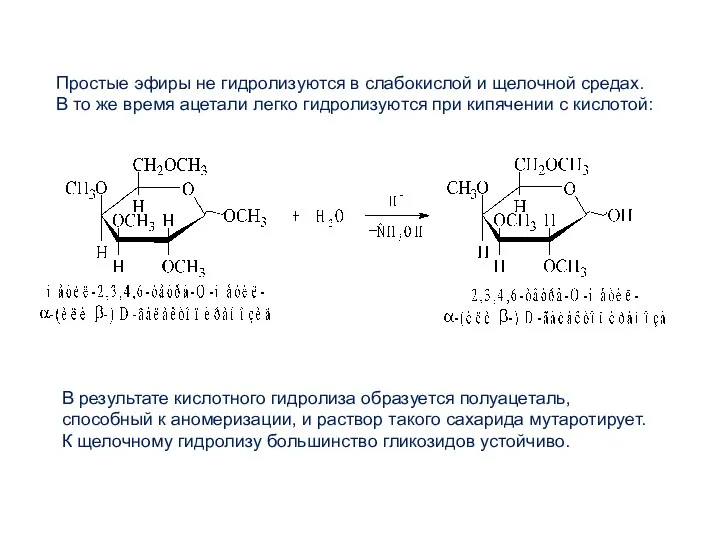
- 23. Простые эфиры не гидролизуются в слабокислой и щелочной средах. В то же время ацетали легко гидролизуются
- 24. 2. Образование сложных эфиров Моносахариды легко вступают в реакцию этерификации с ангидридами карбоновых кислот. Так, действием
- 25. 3. Реакции по карбонильной группе. Укорачивание цепи моносахарида Несмотря на то, что в смеси таутомерных форм
- 26. Удлинение цепи моносахарида Удлинение углеродной цепи можно осуществить циангидринным методом. Взаимодействие альдозы с цианидом натрия приводит
- 27. 4. Реакции окисления-восстановления При восстановлении альдегидной или кето-группы моносахаридов образуются многоатомные спирты. Альдозы образуют один полиол,
- 28. В щелочной среде моносахариды при нагревании окисляются реактивами Толленса, Бенедикта и Фелинга. Окисление в щелочной среде,
- 29. Окисление в нейтральной или кислой среде позволяет сохранить углеродный скелет. При окислении в мягких условиях, н.р.,
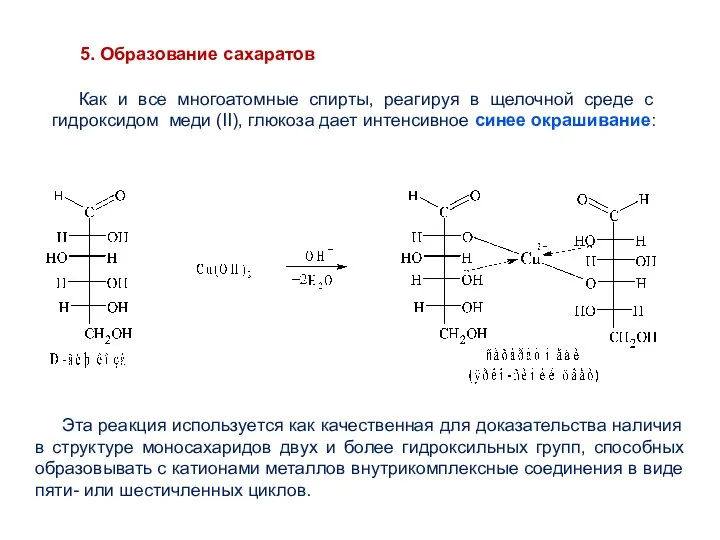
- 30. Как и все многоатомные спирты, реагируя в щелочной среде с гидроксидом меди (II), глюкоза дает интенсивное
- 31. 6. Специфические реакции моносахаридов Отдельные представители могут принимать участие в специфических процессах. Таковым является, н.р., брожение
- 32. 1. Для моносахарида, представленного в открытой форме: 1) Дайте название по международной и тривиальной номенклатуре. 2)
- 34. Скачать презентацию




















 Nucleic acids
Nucleic acids Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии
Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии Заттардың агрегаттық күйі
Заттардың агрегаттық күйі Нефть. Состав. Свойства. Переработка
Нефть. Состав. Свойства. Переработка Относительная атомная масса
Относительная атомная масса Общая характеристика авиационных материалов, тенденции их развития
Общая характеристика авиационных материалов, тенденции их развития Газообразные вещества
Газообразные вещества Сложные эфиры. 10 класс
Сложные эфиры. 10 класс Медь
Медь Вирощування кристалів солей
Вирощування кристалів солей Углерод и его свойства
Углерод и его свойства Сплавы и их свойства. Легирующие добавки
Сплавы и их свойства. Легирующие добавки Элементарные частицы вещества
Элементарные частицы вещества Фосфор и его соединения
Фосфор и его соединения Емдік өсімдіктерден жасалған экстракттың химиялық құрамы мен қасиеттері
Емдік өсімдіктерден жасалған экстракттың химиялық құрамы мен қасиеттері Природні джерела вуглеводнів і їх переробка
Природні джерела вуглеводнів і їх переробка Растворение. Растворы
Растворение. Растворы Строение атома
Строение атома Спирты
Спирты Строение вещества. Химическая связь
Строение вещества. Химическая связь Алкадиены (диены, диеновые углеводороды)
Алкадиены (диены, диеновые углеводороды) Теория электролитической диссоциации
Теория электролитической диссоциации Сахароза
Сахароза Азот
Азот Экспресс-методы решения задач по химии
Экспресс-методы решения задач по химии Биологически важные окислительно-восстановительные реакции органических соединений
Биологически важные окислительно-восстановительные реакции органических соединений Растворы. Классификация, способы выражения концентрации, свойства растворов
Растворы. Классификация, способы выражения концентрации, свойства растворов Студенттің өзіндік жұмысы
Студенттің өзіндік жұмысы