Слайд 2

Слайд 3

Физические свойства углерода
Алмаз-самое твёрдое природное соединение на Земле. Это прозрачное,бесцветное, кристаллическое
вещество.
Графит-мягкий, непрозрачный, серого цвета, маслянистый и блестящий. Имеет температуру плавление 2000 градусов по Цельсию и при низком давлении превращается в карбин.
В последнее время открыли ещё одну формулу-фуллерен. У него структура, как у футбольного мяча.
Слайд 4

Химические свойства углерода
Взаимодействия с простыми веществами:
1) При сгорании углерода:
а)2C+O2= 2CO (Оксид
углерода 2)
б)C+O2= CO2 (Оксид углерода 4)
2)С металлами образуется карбиды:
2C+Ca=CaC2 (Карбид кальция)
3C+4Al=Al4C3 (Карбид алюминия)
3)С серой образуется сероуглерод;
C+2S=CS2
4)С водородом образуются метан:
C+2H2= CH4
5)С хлором образуются хлоропроизводные:
C+2Cl2= CCl2 (Четыреххлористый углерод)
Слайд 5

Взаимодействия со сложными веществами:
1)с водой образуется водяной газ:
C+H2O=CO+H2
2)с серной и азотной
кислотами
C+4HNO3=CO2+4NO2+2H2
C+2H2SO4=CO2+2SO2+2H2O
Слайд 6

Получение
При разложение древесины без доступа в воздух и при обугливании
органических соединений образуется углерод (сажа).
C6H12O6=6C+6H2O
Слайд 7

Применение
Алмаз используют для резки стекла. Из алмаза делают украшения (бриллианты).
Графит
применяют для изготовления электродов, а также грифелей карандашей.
Кокс (С) используется в производстве металлов как восстановитель.






 Полиэтилен
Полиэтилен Реакции терпеноидов. Тема № 4
Реакции терпеноидов. Тема № 4 Кислотність та основність органічних сполук
Кислотність та основність органічних сполук Химические свойства карбоновых кислот
Химические свойства карбоновых кислот Методы разделения и концентрирования. Хроматографические методы
Методы разделения и концентрирования. Хроматографические методы Теория электролитической диссоциации
Теория электролитической диссоциации Химические волокна. Полиэфирные волокна. Лавсан
Химические волокна. Полиэфирные волокна. Лавсан Водородные и кислородные соединения неметаллов. Галогеноводороды. Соляная кислота
Водородные и кислородные соединения неметаллов. Галогеноводороды. Соляная кислота Азотная кислота
Азотная кислота Химические реакции
Химические реакции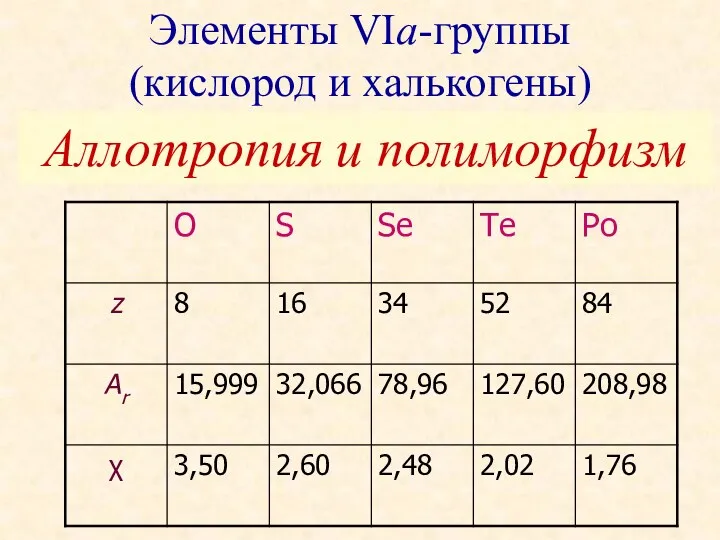 Элементы VIа-группы (кислород и халькогены). Аллотропия и полиморфизм
Элементы VIа-группы (кислород и халькогены). Аллотропия и полиморфизм Негізгі топша элементтерінің химиясы
Негізгі топша элементтерінің химиясы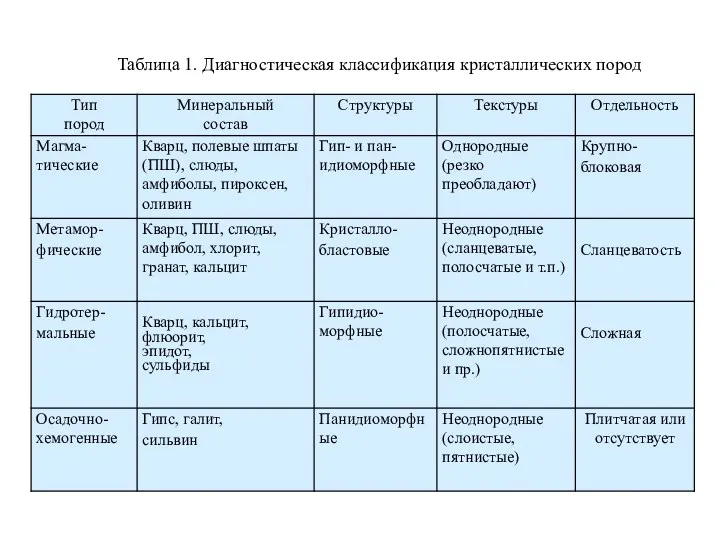 Диагностика метаморфических и гидротермальных горных пород
Диагностика метаморфических и гидротермальных горных пород Химияны оқыту әдістері
Химияны оқыту әдістері Окислительно-восстановительные реакции. Основные положения электронной теории ОВР
Окислительно-восстановительные реакции. Основные положения электронной теории ОВР Металлы – простые вещества
Металлы – простые вещества Молибденовые сплавы
Молибденовые сплавы Амины. Анилин
Амины. Анилин Массообменные процессы
Массообменные процессы Синтетические моющие средства
Синтетические моющие средства Ненасыщенные углеводороды. Алкены
Ненасыщенные углеводороды. Алкены Химия и проблемы охраны окружающей среды
Химия и проблемы охраны окружающей среды Plastics слайды
Plastics слайды Наноалотропи карбону: класифікація, одержання та застосування
Наноалотропи карбону: класифікація, одержання та застосування Оптические свойства и методы исследования дисперсных систем. Лекция 16
Оптические свойства и методы исследования дисперсных систем. Лекция 16 Атом – сложная частица
Атом – сложная частица Основы термодинамики
Основы термодинамики Состав энергетических напитков
Состав энергетических напитков