Содержание
- 2. Общая электронная формула: […] ns 2 (n–1)d 10np 4 Степени окисления: O: –II, –I, 0, +I,
- 3. Молекула O8 в форме ринга. Образует темно-красные кристаллы. Получается при сверхвысоких давлениях. ~2.34 Å 1.20 Å→
- 4. ~2.3 Å 1.2 Å→ Гомоатомные молекулы, различающиеся количеством входящих в них атомов и (или) строением относятся
- 5. Физические и химические свойства O2 O2 – газ без цвета, запаха и вкуса, т.пл. –218,7 °С,
- 6. (Ди)кислород (O2)... притягивается к магниту
- 7. Итак, O8 и O2 – это аллотропные формы кислорода. А где же всем известный озон O3?
- 8. Характеристические реакции озона: К слову: может ли гомоатомная молекула представлять собой диполь ? 2Cu+2(OH)2 + 6OH-
- 9. Проблема озонового слоя Образование озона: Разрушение озона: Разрушение озона. Фреоновый цикл:
- 10. Итак, у кислорода есть молекулярные формы O2, O3, O8. Вероятно, есть еще O4 . Близкие к
- 11. Характеристические реакции синглетного кислорода:
- 12. Молекулы N2 (:N≡N:) находятся в любых фазах простого вещества, кроме гигантских давлений Есть ли другие формы
- 13. D. Tomasino, et al. Phys. Rev. Lett. 113, 205502 (2014) При высоких давлениях возникают молекулы N4,
- 14. Фосфор: белый, красный (фиолетовый) и черный Молекула белого фосфора P4 Полимеризация белого фосфора и кристаллич. структура
- 15. Хемилюминесценция нанесенного на пористую бумагу белого фосфора при окислении кислородом воздуха
- 16. Аллотропия серы (Проявляется во всех трех агрегатных состояниях) Молекула серы S8 и вид этой молекулы «сверху»
- 17. Полиморфные модификации серы Структура ромбической (слева) и моноклинной серы (справа)
- 18. Превращения серы при постепенном нагревании и резком закаливании (см. подписи над стрелками) Моноклинная и ромбическая сера:
- 19. Углерод Аллотропия и полиморфизм Углерод: алмаз (sp3), графит (sp2), карбин (sp), фуллерены (sp2 + sp3) .
- 20. Алмаз Бесцветные прозрачные кристаллы, диэлектрик, ювелирный драгоценный камень (бриллиант), плотность 3,515 г/см3. Крист. решетка атомная (sp3-гибридизация).
- 21. Простые вещества. Углерод Аллотропия и полиморфизм Углерод: алмаз (sp3), графит (sp2), карбин (sp), фуллерен. Структура графита
- 22. Графит Т. пл. 3800 °С, т. кип. 4000 °С, плотность 2,27 г/см3, электропроводен, устойчив. Типичный восст-ль
- 23. Простые вещества. Углерод Аллотропия и полиморфизм Углерод: алмаз (sp3), графит (sp2), карбин (sp), фуллерен. Структура графита
- 24. Простые вещества. Углерод Аллотропия и полиморфизм Углерод: алмаз (sp3), графит (sp2), карбин (sp), фуллерен. Структура фуллеренов:
- 25. Карбин: линейные макромолекулы (С2)n, бесцветен и прозрачен, полупроводник; плотность 3,27 г/см3; выше 2300 °С переходит в
- 26. Полиморфи́зм (от греч. πολύμορφος «многообразный») — способность вещества существовать в различных кристаллических структурах, называемых полиморфными модификациями.
- 27. Изомерия (от др.-греч. ἴσος — равный + μέρος — доля, часть) — явление, заключающееся в существовании
- 29. Скачать презентацию
 Состав энергетических напитков
Состав энергетических напитков циклоалканы170
циклоалканы170 Д.И. Менделеевтің периодтық заңы жəне аналитикалық заттардың химиялық қасиеттері
Д.И. Менделеевтің периодтық заңы жəне аналитикалық заттардың химиялық қасиеттері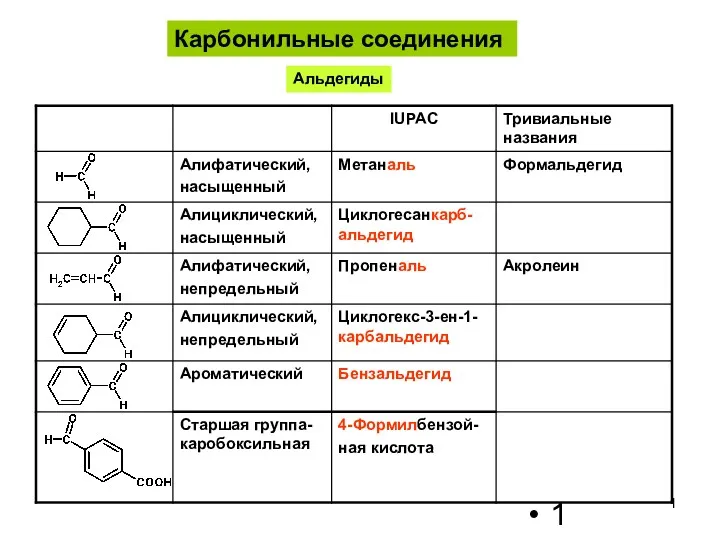 Карбонильные соединения. Альдегиды
Карбонильные соединения. Альдегиды Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Магматические горные породы
Магматические горные породы 20230219_prezentatsiya_k_uroku_neft
20230219_prezentatsiya_k_uroku_neft Биогенные элементы периодической системы
Биогенные элементы периодической системы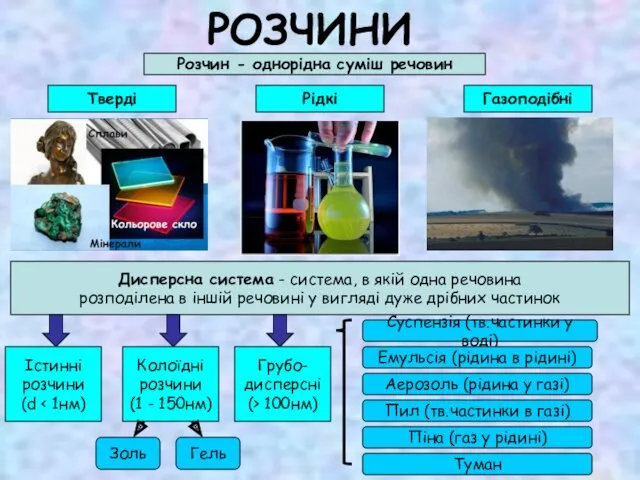 Розчини
Розчини Химическая промышленность
Химическая промышленность Құймалар. Механикалық қоспа
Құймалар. Механикалық қоспа Химические свойства алканов
Химические свойства алканов Ароматические соединения
Ароматические соединения Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №13
Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №13 Урок + презентация Азот. 9 класс.
Урок + презентация Азот. 9 класс. Закон сохранения массы вещества. Уравнения химических
Закон сохранения массы вещества. Уравнения химических СФ- И ЯМР-ИССЛЕДОВАНИЕ РЕДОКС-ПРОЦЕССОВ В СИСТЕМЕ Со(II)-ЭДТА-H2O2
СФ- И ЯМР-ИССЛЕДОВАНИЕ РЕДОКС-ПРОЦЕССОВ В СИСТЕМЕ Со(II)-ЭДТА-H2O2 Классы неорганических соединений
Классы неорганических соединений Электрохимические процессы
Электрохимические процессы Облагораживание тяжелых нефтей и природных битумов
Облагораживание тяжелых нефтей и природных битумов Алмазы. Бриллианты
Алмазы. Бриллианты Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Качественные реакции на органические вещества
Качественные реакции на органические вещества Бензен як представник ароматичних вуглеводнів
Бензен як представник ароматичних вуглеводнів Жёсткость воды
Жёсткость воды Окислительно-восстановительные реакции. Лабораторная работа
Окислительно-восстановительные реакции. Лабораторная работа Классификация химических элементов. 8 класс
Классификация химических элементов. 8 класс Биохимическая трансформация веществ (2)
Биохимическая трансформация веществ (2)