Содержание
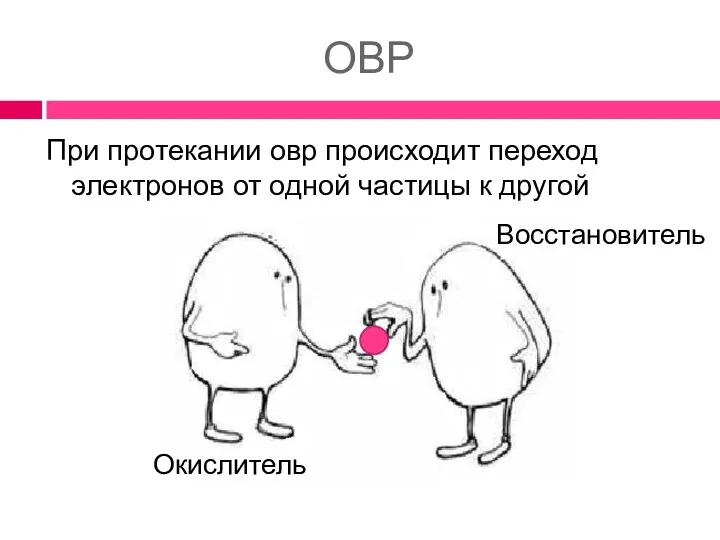
- 2. ОВР При протекании овр происходит переход электронов от одной частицы к другой Восстановитель Окислитель
- 3. Отличия электролиза от ОВР Ионы, достигающие поверхности электродов , и разряжаются и изменяют свой заряд!!! В
- 4. Электрический ток Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под
- 5. Электролиз Электролиз – это окислительно — восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока
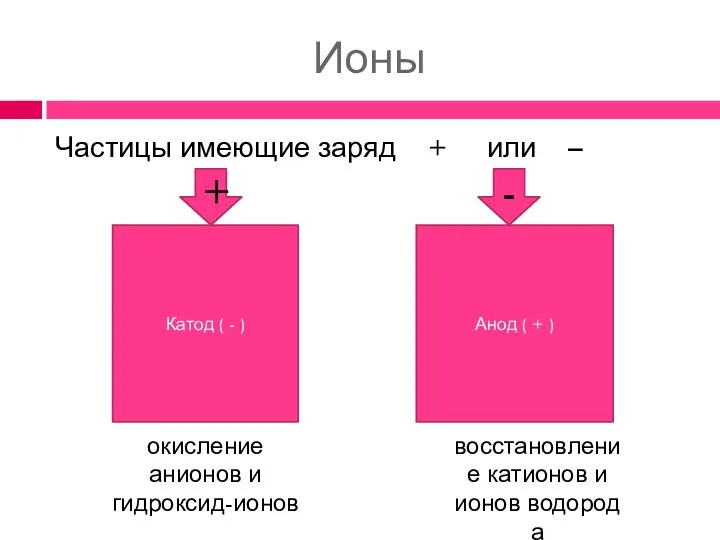
- 6. Ионы Частицы имеющие заряд + или – Катод ( - ) Анод ( + ) окисление
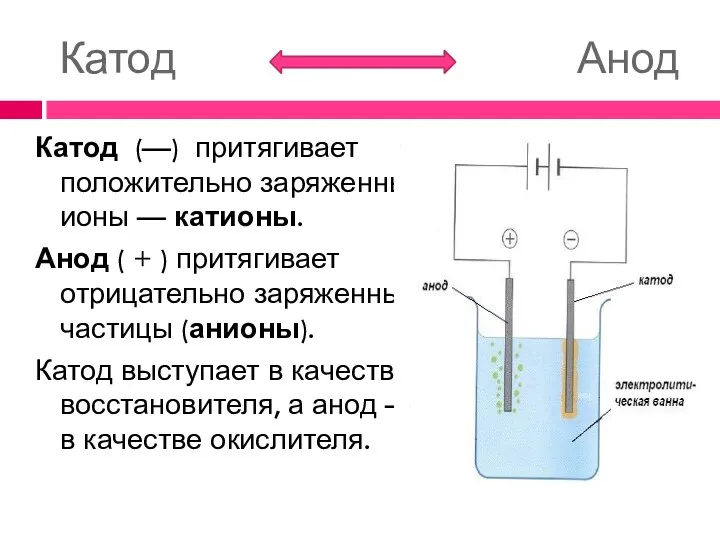
- 7. Катод Анод Катод (—) притягивает положительно заряженные ионы — катионы. Анод ( + ) притягивает отрицательно
- 8. Виды электродов Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди,
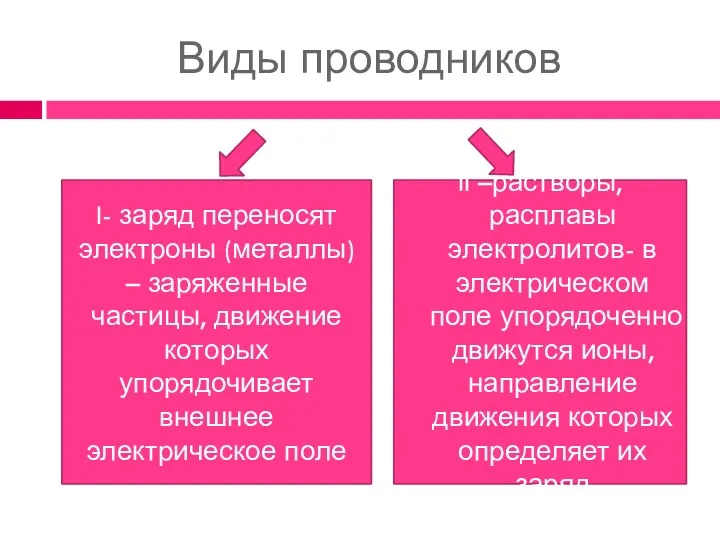
- 9. Виды проводников I- заряд переносят электроны (металлы) – заряженные частицы, движение которых упорядочивает внешнее электрическое поле
- 10. Электролиз расплавов электролитов Расплавление солей и щелочей веществ с ионным типом связи = ионы в расплаве
- 11. Электролиз расплава гидроксида калия KOH = K+ + OH – Катод ( - )K+ + e
- 12. Электролиз растворов электролитов В растворах электролитов помимо катионов и анионов электролита участвуют молекулы воды Бромид меди
- 13. Электролиз растворов электролитов Na Cl= Na+ + Cl – Катод ( -) : 2 H 2
- 14. Электролиз растворов Катод (–): Cu2+ + 2ē → Cu0 Анод (+): 2H2O-2 – 4ē → O2
- 15. Электролиз раствора соли Соль состоящая из катиона щелочного металла и аниона кислородосодержащей кислоты При пропускании электрического
- 17. Скачать презентацию










 Углеводородное топливо, его виды и назначения
Углеводородное топливо, его виды и назначения Соединения химических элементов. Урок-игра. 8 класс
Соединения химических элементов. Урок-игра. 8 класс Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе
Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе Гетерофункциональные соединения
Гетерофункциональные соединения Циклоалканы
Циклоалканы Mineralogy. Chemical composition and properties of minerals
Mineralogy. Chemical composition and properties of minerals Введение в геологию и минералогию
Введение в геологию и минералогию Электрохимические системы
Электрохимические системы Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ
Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ Нефть
Нефть Классификация химических реакций
Классификация химических реакций Гибридизация электронных орбиталей и геометрия молекул
Гибридизация электронных орбиталей и геометрия молекул Важнейшие классы бинарных соединений – оксиды и летучие соединения
Важнейшие классы бинарных соединений – оксиды и летучие соединения Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Атмосфера. Химия стратосферы
Атмосфера. Химия стратосферы Обмен индивидуальных аминокислот
Обмен индивидуальных аминокислот Вещества в твоей жизни
Вещества в твоей жизни Біохімія вуглеводів
Біохімія вуглеводів Оксиды. 9 класс
Оксиды. 9 класс Вуглеводи
Вуглеводи Нефть как природный источник углеводородов
Нефть как природный источник углеводородов Признаки химических реакций
Признаки химических реакций Металдардың химиялық белсенділігі
Металдардың химиялық белсенділігі Химический элемент водород
Химический элемент водород Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева Химико-лесной комплекс
Химико-лесной комплекс