Содержание
- 2. «Химическое превращение, химическая реакция есть главный предмет химии». Н.Н.Семёнов
- 3. По числу и составу реагирующих и образующихся веществ По изменению степени окисления атомов элементов По использованию
- 6. Реакции при которых не меняется состав вещества Изомеризация — перегруппировка атомов в молекуле вещества без изменения
- 7. Реакции при которых меняется состав вещества РЕАКЦИИ СОЕДИНЕНИЯ РЕАКЦИИ РАЗЛОЖЕНИЯ РЕАКЦИИ ЗАМЕЩЕНИЯ РЕАКЦИИ ОБМЕНА
- 8. РЕАКЦИИ СОЕДИНЕНИЯ 2H2 + O2 2H2O несколько веществ одно более сложное вещество Реакциями соединения называют реакции,
- 9. РЕАКЦИИ РАЗЛОЖЕНИЯ Cu(OH)2 CuO + H2O одно сложное вещество несколько веществ Реакциями разложения называют реакции, при
- 10. РЕАКЦИИ ЗАМЕЩЕНИЯ Fe + CuSO4 FeSO4 + Cu ПРОСТОЕ ВЕЩЕСТВО СЛОЖНОЕ ВЕЩЕСТВО Реакциями замещения называют реакции,
- 11. РЕАКЦИИ ОБМЕНА BaCl2+ H2SO4 BaSO4 + 2HCl Реакциями обмена называют реакции, при которых два сложных вещества
- 12. ОБМЕНА АВ+СД=АД+ВС АВ+СД=АС+ВД РАЗЛОЖЕНИЕ АВ = А+В ЗАМЕЩЕНИЕ АВ+С=АС+В АВ+С=ВС+А СОЕДИНЕНИЕ А + В = АВ
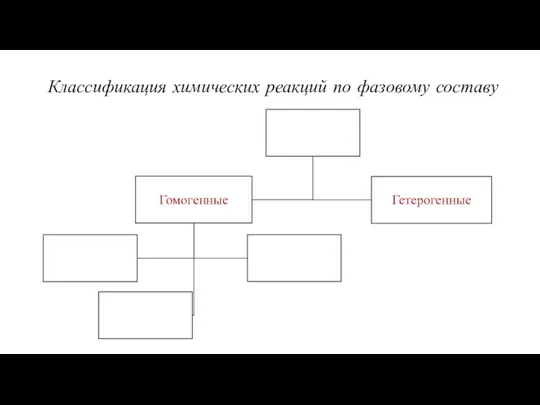
- 13. Классификация химических реакций по фазовому составу
- 14. Классификация химических реакций по фазовому составу Реакция называется гомогенной когда все участвующие в реакции вещества, находятся
- 15. Классификация химических реакций по фазовому составу Реакция называется гетерогенной когда в реакции находятся вещества в различных
- 16. Классификация химических реакций по признаку обратимости Необратимые реакции - протекают только в одном направлении. Признаки необратимости:
- 17. Классификация химических реакций по тепловому эффекту Экзотермические реакции - протекают с выделением теплоты С + O2
- 18. Классификация химических реакций по наличию катализатора Каталитические реакции - протекают с участием катализатора Некаталитические реакции -
- 19. В качестве примера рассмотрим реакцию разложения этилового спирта СН3СН2ОН (этанола). Без катализатора эта реакция идет с
- 20. Использование серной кислоты H2SO4 в качестве гомогенного катализатора позволяет получать этилен из этанола уже при 170оС.
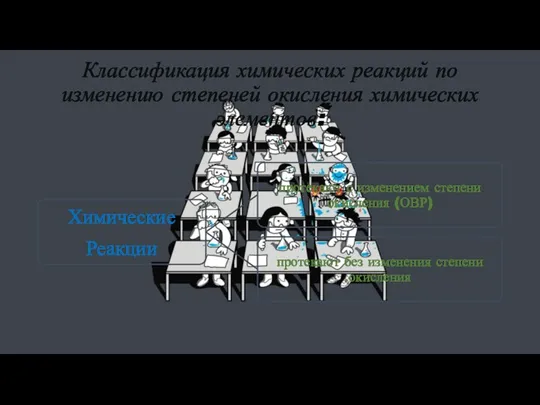
- 21. Классификация химических реакций по изменению степеней окисления химических элементов:
- 22. Классификация химических реакций по изменению степеней окисления химических элементов: Окислительно-восстановительные реакции – реакции, идущие с изменением
- 23. Классификация химических реакций по изменению степеней окисления химических элементов: Реакции, которые протекают без изменения степени окисления
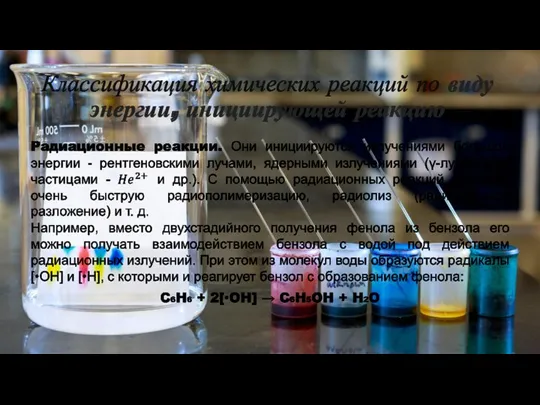
- 24. Классификация химических реакций по виду энергии, инициирующей реакцию
- 25. Классификация химических реакций по виду энергии, инициирующей реакцию ФОТОХИМИЧЕСКИЕ РЕАКЦИИ – химические превращения, протекающие под действием
- 26. Природные фотохромы Содалит Na4(Si3Al3)O12Cl Содалит меняет цвет от фиолетового (на свежем разломе) до бледно-желтого, бледно-зеленого или
- 27. Фотохромизм - обратное явление, во время которого вещество обесцвечивается по действием излучения. Фотохромизм 1-NDPI-8-TPI-naphthalene Комплекс 1,1´-binaphthyl-bridged
- 28. Классификация химических реакций по виду энергии, инициирующей реакцию
- 29. Классификация химических реакций по виду энергии, инициирующей реакцию Электрохимические реакции. Их инициирует электрический ток. Помимо хорошо
- 30. Классификация химических реакций по механизму протекания
- 31. Радикальные реакции Радикал – это атом или группа атомов, имеющих неспаренный электрон. Если вещество образовано за
- 32. Типичные ионные реакции - это взаимодействие между электролитами в растворе. Ионы образуются не только при диссоциации
- 35. Скачать презентацию





























 Практическая работа. Химический состав клетки
Практическая работа. Химический состав клетки Максимально очищенные фитопрепараты. Технология и стандартизация
Максимально очищенные фитопрепараты. Технология и стандартизация B13. Задачи на концентрацию и сплавы
B13. Задачи на концентрацию и сплавы Химические элементы в организме человека
Химические элементы в организме человека Типы заданий. ЕГЭ №32
Типы заданий. ЕГЭ №32 Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы
Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы Аммиак. 9 класс
Аммиак. 9 класс Sulfur and its compounds. Contact method for producing sulfuric acid
Sulfur and its compounds. Contact method for producing sulfuric acid Состав, строение и свойства аминокислот
Состав, строение и свойства аминокислот Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання
Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання Коррозия и защита строительных материалов
Коррозия и защита строительных материалов Методы очистки нефтяных фракций
Методы очистки нефтяных фракций Классификация химических реакций
Классификация химических реакций Амины. Номенклатура аминов
Амины. Номенклатура аминов 21. Кислоты. Определение кислот
21. Кислоты. Определение кислот Химико-аналитический контроль. Основы химико-аналитического контроля товаров
Химико-аналитический контроль. Основы химико-аналитического контроля товаров Кислородные соединения азота
Кислородные соединения азота Природные источники углеводородов
Природные источники углеводородов Атомы химических элементов
Атомы химических элементов Анализ качества лекарственных веществ, определяемых методом комплексонометрии
Анализ качества лекарственных веществ, определяемых методом комплексонометрии Аргентум, или серебро
Аргентум, или серебро Система питания двигателя от газобаллонной установки
Система питания двигателя от газобаллонной установки Оксиды и гидроксиды
Оксиды и гидроксиды Целлюлоза
Целлюлоза Металлические сплавы
Металлические сплавы Химия, как часть естествознания. Предмет химии
Химия, как часть естествознания. Предмет химии Карбоновые кислоты (часть 1)
Карбоновые кислоты (часть 1) Химическая термодинамика. Задачи
Химическая термодинамика. Задачи