Содержание
- 2. Ядерные реакции : Расщепление ядер 92U + 0n = 36Kr + 56Ва + 2 0n Термоядерный
- 3. ВВЕДЕНИЕ Химические реакции – химические процессы, в результате которых из одних веществ образуются другие отличающиеся от
- 4. Типы химических реакций Классификации(стр. 115) По числу и составу реагирующих веществ. По изменению степеней окисления химических
- 5. По числу и составу реагентов Реакции, идущие без изменения состава вещества. Реакции аллотропизации С (графит) →
- 6. Реакции изомеризации (перегруппировки) С4Н10 (бутан) → С4Н10 (изобутан) Аллотропия и изомерия – причины многообразия веществ!
- 7. Реакции, идущие с изменением состава вещества. Реакции соединения(присоединения) Реакции разложения(отщепления) Реакции замещения Реакции обмена
- 8. Реакции соединения-... А + В + … = С(сложное) Гидрирование (+Н2) Гидрогалогенирование (+HCl, HBr) Галогенирование (+Cl2,
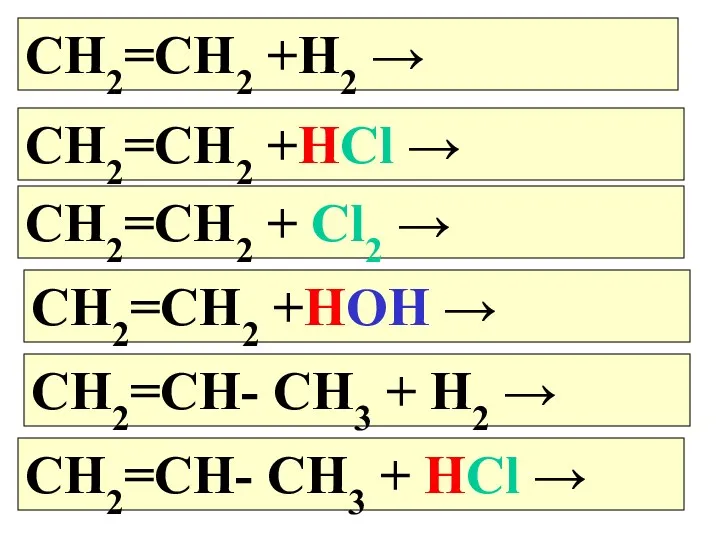
- 9. СН2=СН2 +Н2 → СН2=СН2 +НCl → СН2=СН2 + Cl2 → СН2=СН2 +НOH → СН2=СН- СН3 +
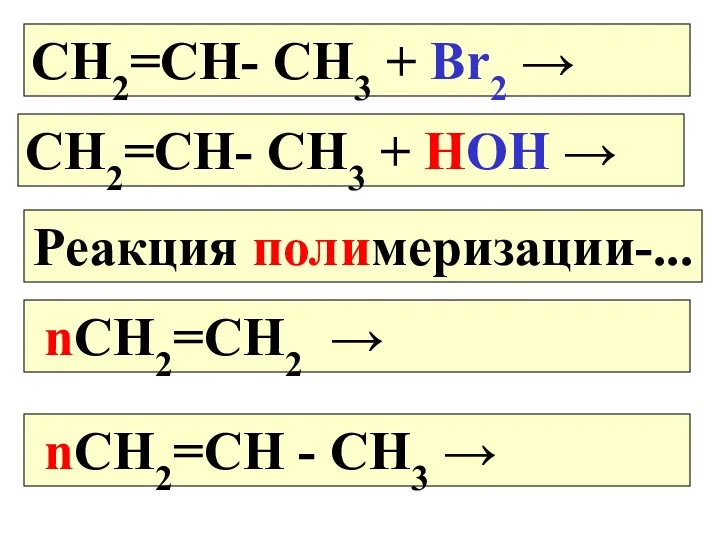
- 10. СН2=СН- СН3 + Br2 → СН2=СН- СН3 + НOH → Реакция полимеризации-... nСН2=СН2 → nСН2=СН -
- 11. Реакция соединения кислотного оксида фосфора(V) с водой: Р2 О5 + …H2O = … ОГЛАВЛЕНИЕ Классификация реакций
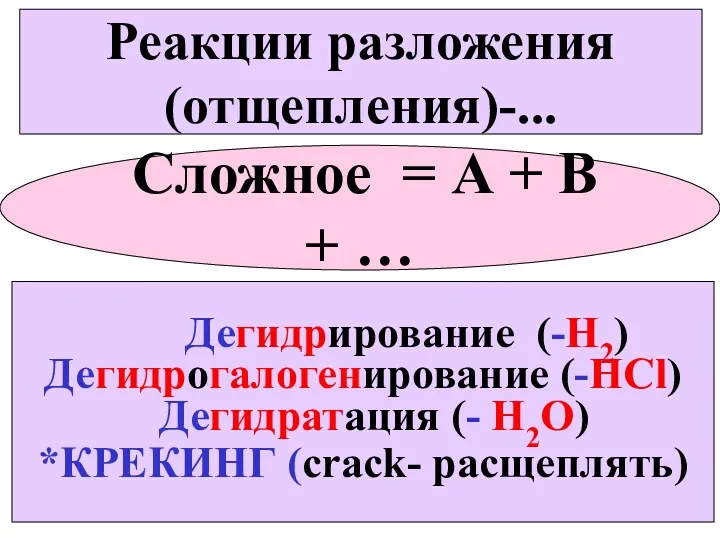
- 12. Реакции разложения (отщепления)-... Сложное = А + В + … Дегидрирование (-Н2) Дегидрогалогенирование (-HCl) Дегидратация (-
- 13. Реакция взаимодействия сахара с концентрированной серной кислотой ОГЛАВЛЕНИЕ Интересные реакции
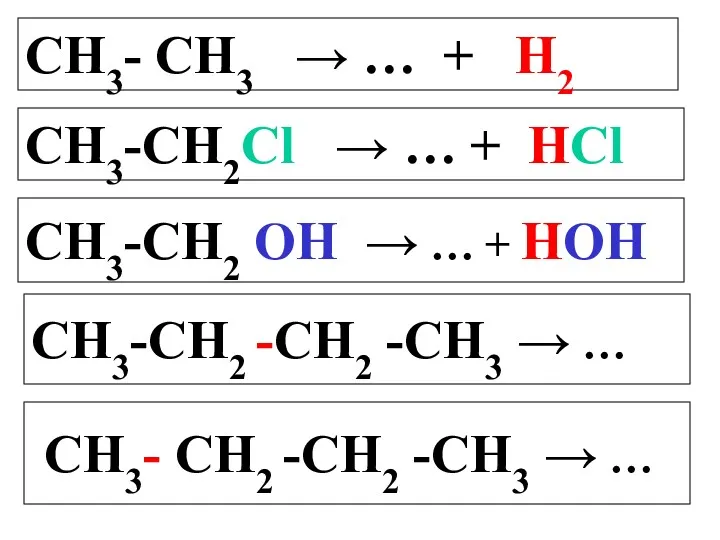
- 14. СН3- СН3 → … + Н2 СН3-СН2Cl → … + НCl СН3-СН2 OH → … +
- 15. Разложение перманганата калия при нагревании: Разгорание тлеющей лучины свидетельствует от том, что происходит выделение кислорода: …KMnO4
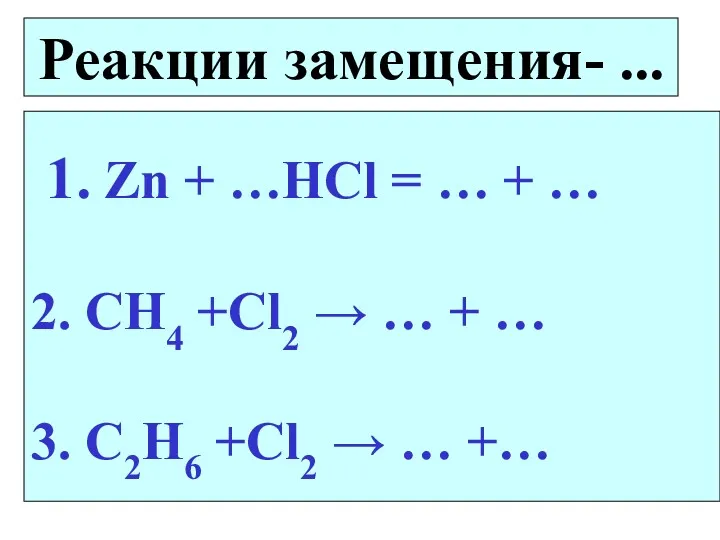
- 16. Реакции замещения- ... 1. Zn + …HCl = … + … 2. CH4 +Cl2 → …
- 17. Взаимодействие щелочного металла кальция с водой: Са + …Н2О = … + …⭡ ОГЛАВЛЕНИЕ Классификация реакций
- 18. Взаимодействие щелочного металла натрия с водой: ...Na + … = ...NaOH + …⭡ ОГЛАВЛЕНИЕ Классификация реакций
- 19. Реакции обмена Реакции между двумя сложными веществами, которые обмениваются своими составными частями. AgNO3 + HCl →
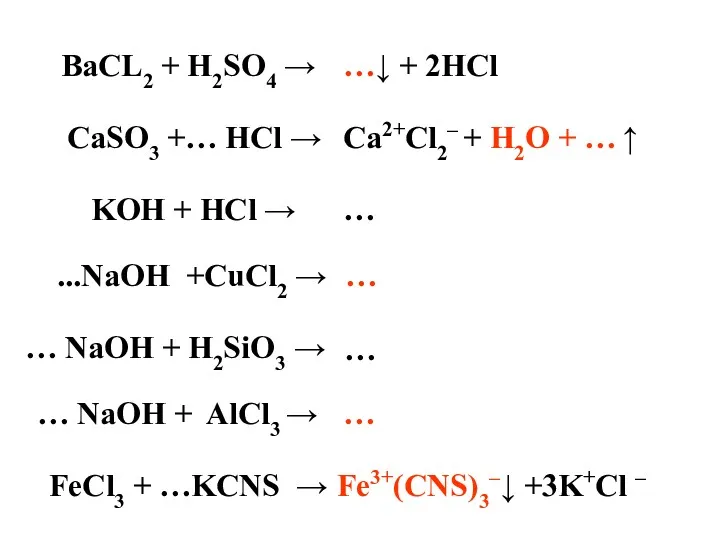
- 20. BaCL2 + H2SO4 → …↓ + 2HCl CaSO3 +… HCl → Ca2+Cl2– + H2O + …
- 21. Определите тип реакции ? 1) nCH2=CH2 → (-CH2-CH2-)n 2) C8H18→ C4H10 + C4H8 3) 4 NO2
- 22. 2. По изменению степеней окисления химических элементов, образующих вещества: Окислительно-восстановительные реакции: Окислительно-восстановительные реакции – реакции, идущие
- 23. Окислительно-восстановительная реакция: горение магния Сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса ОГЛАВЛЕНИЕ 0 0
- 24. Реакция взаимодействия фосфора с азотной кислотой: ОГЛАВЛЕНИЕ Интересные реакции
- 25. Не окислительно-восстановительные реакции: К ним относятся все реакции ионного обмена, например: Na2CO3 + 2HCl = 2NaCl
- 26. 3. По участию катализатора: Катализаторы – это вещества, участвующие в химической реакции и изменяющие ее скорость
- 27. Каталитическая реакция взаимодействия алюминия с йодом: H2O 4Al + 3I2 ⭢ 2AlI3 ОГЛАВЛЕНИЕ Классификация реакций
- 28. 4. По агрегатному состоянию реагирующих веществ (фазовому составу): Гетерогенные реакции: Гетерогенные реакции – реакции, в которых
- 29. 5. По тепловому эффекту: Экзотермические реакции: Экзотермические реакции – реакции, протекающие с выделением энергии во внешнюю
- 30. Эндотермические реакции: Эндотермические реакции – реакции, протекающие с поглощением энергии во внешнюю среду. К ним относятся
- 31. 6. По направлению: Необратимые реакции: Необратимые реакции протекают в данных условиях только в одном направлении. К
- 32. Реакция горения кальция на воздухе: Реакции горения протекают очень бурно ОГЛАВЛЕНИЕ Интересные реакции
- 33. Реакция горения лития: ОГЛАВЛЕНИЕ
- 35. Скачать презентацию


























 Химия нефти и газа
Химия нефти и газа Ацидиметрия. Стандартизация
Ацидиметрия. Стандартизация Методика проверки и оценивания заданий с развернутым ответом линии 30 и 31
Методика проверки и оценивания заданий с развернутым ответом линии 30 и 31 Геохимические показатели техногенеза
Геохимические показатели техногенеза Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар Электрохимический ряд напряжения металлов
Электрохимический ряд напряжения металлов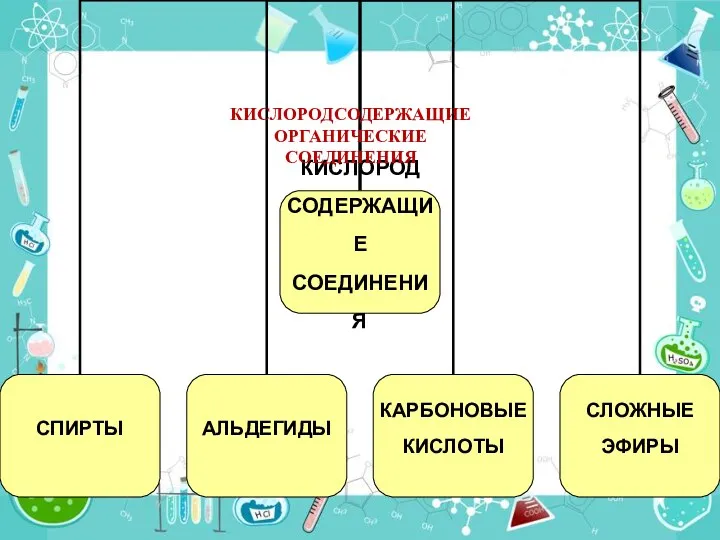 Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Классификация химических элементов. 8 класс
Классификация химических элементов. 8 класс альдегиды, свойства, получение
альдегиды, свойства, получение Углерод, аллотропные модификации
Углерод, аллотропные модификации Методы определения Тст и Тт полимеров
Методы определения Тст и Тт полимеров Что такое алмаз
Что такое алмаз Закон сохранения массы вещества. Уравнения химических
Закон сохранения массы вещества. Уравнения химических Алкадиены
Алкадиены Азотная кислота и ее соли
Азотная кислота и ее соли Синтетические моющие средства
Синтетические моющие средства Полезные геологические химические соединения. Получение меди из малахита
Полезные геологические химические соединения. Получение меди из малахита Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Хімічні формули речовин. Урок №14
Хімічні формули речовин. Урок №14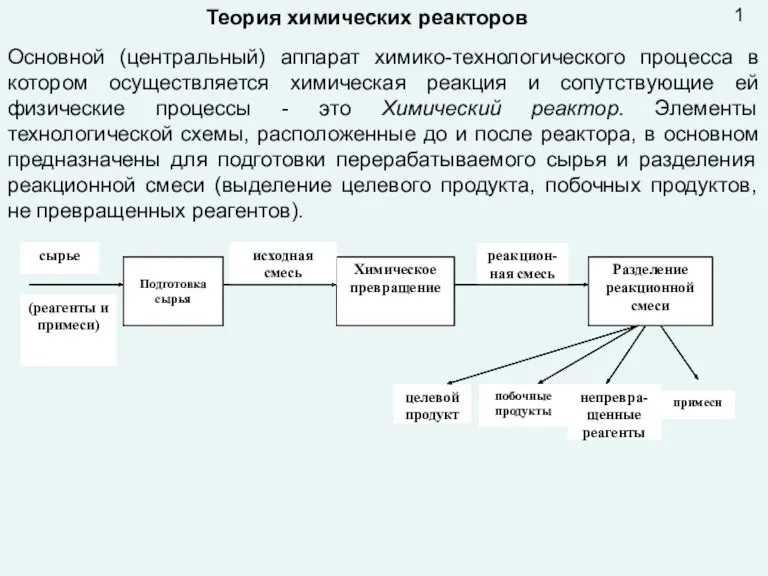 Презентация лекция 9 Реактора
Презентация лекция 9 Реактора Азотная кислота
Азотная кислота Основные классы неорганических соединений
Основные классы неорганических соединений Химия органических соединений. Углеводороды
Химия органических соединений. Углеводороды Токсическое действие диоксинов и диоксиноподоных соединений
Токсическое действие диоксинов и диоксиноподоных соединений Аммиак. 9 класс
Аммиак. 9 класс Полимеры. Мономер
Полимеры. Мономер Чистые вещества и смеси
Чистые вещества и смеси Спирти
Спирти