Содержание
- 2. Из истории химических имён. Строение молекулы аммиака. Физические свойства аммиака. Действие на организм. Правила обращения с
- 3. Бог Амон в образе барана VIII в. до н.э. (Музей г. Мероэ, Судан)
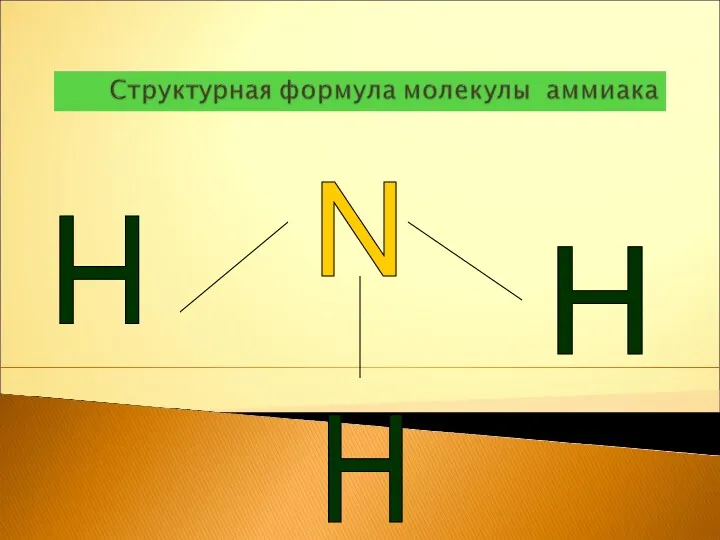
- 4. N H 3
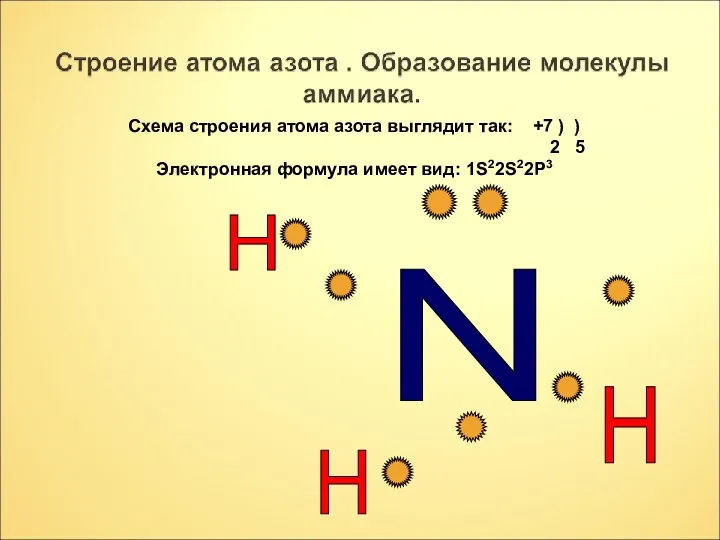
- 5. N H H H Схема строения атома азота выглядит так: +7 ) ) 2 5 Электронная
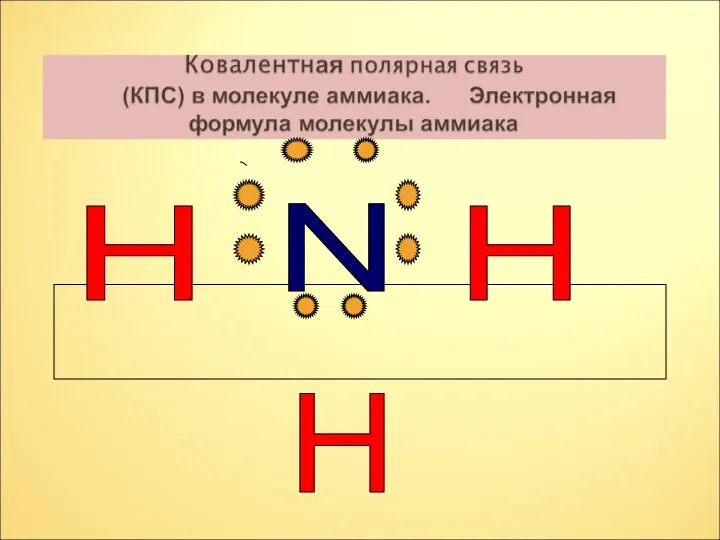
- 7. N H H H
- 8. N H H H
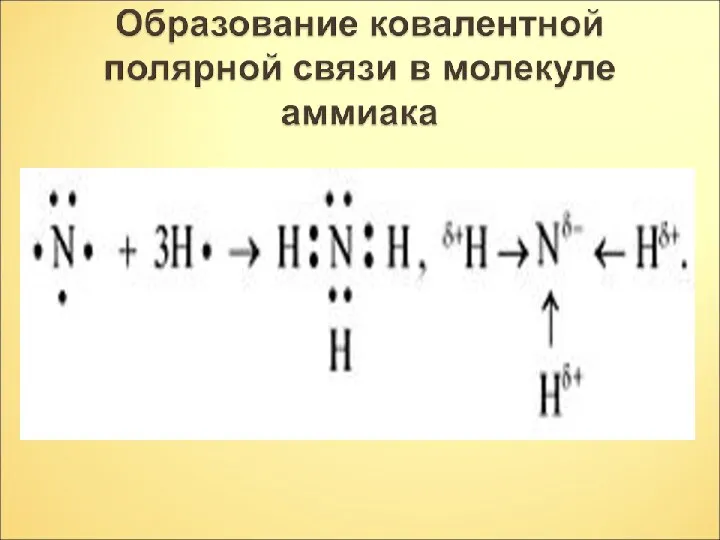
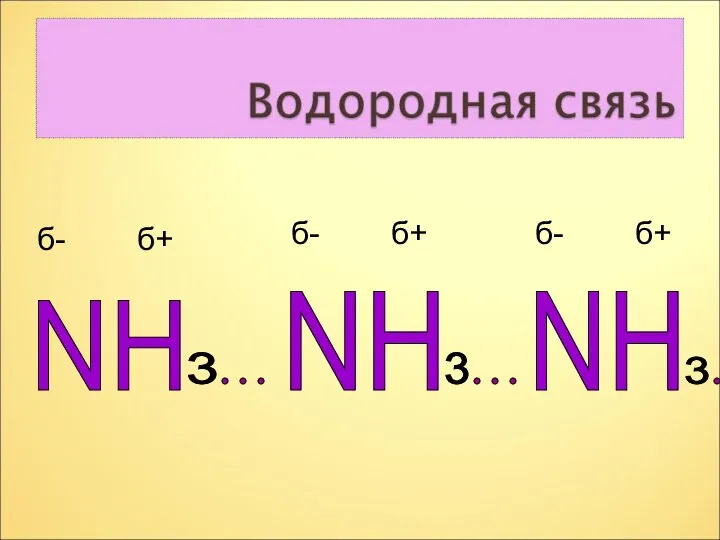
- 10. NH NH 3 3 3 NH б- б+ б- б+ б- б+
- 11. Вывод. Наличие не поделённой электронной пары на атоме азота и присутствие трёх полярных ковалентных связей в
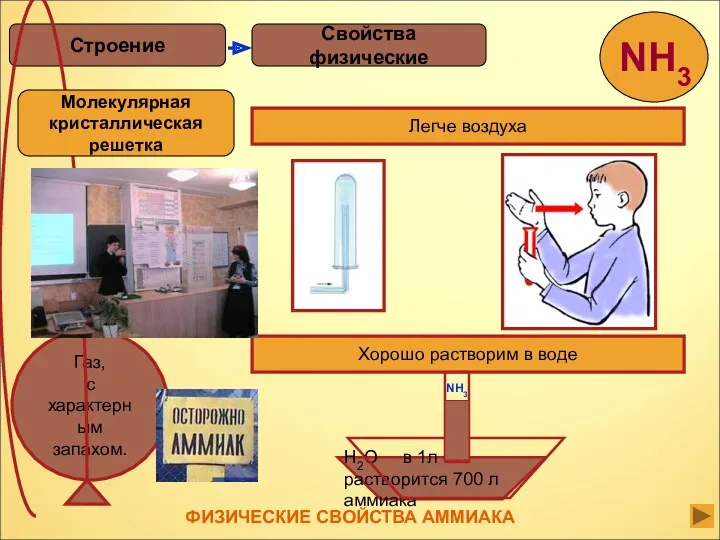
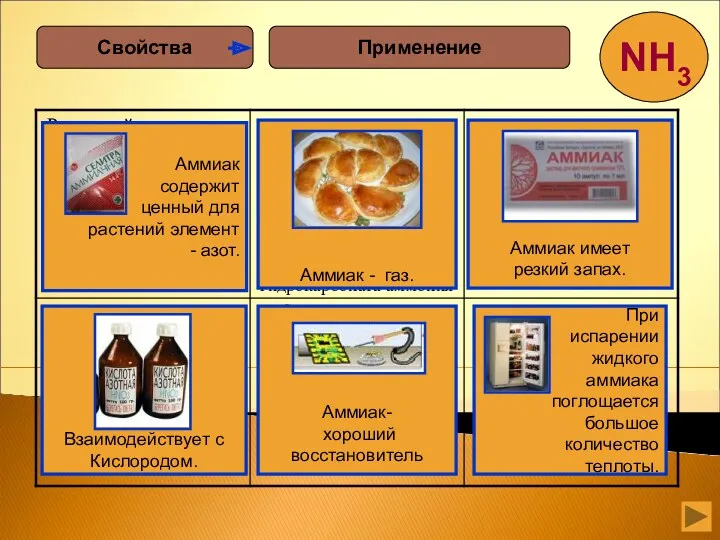
- 12. Аммиак –это газ, бесцветный, с резким запахом, ядовит, сжижается при –33,35 °С, затвердевает при –77,7 °С.
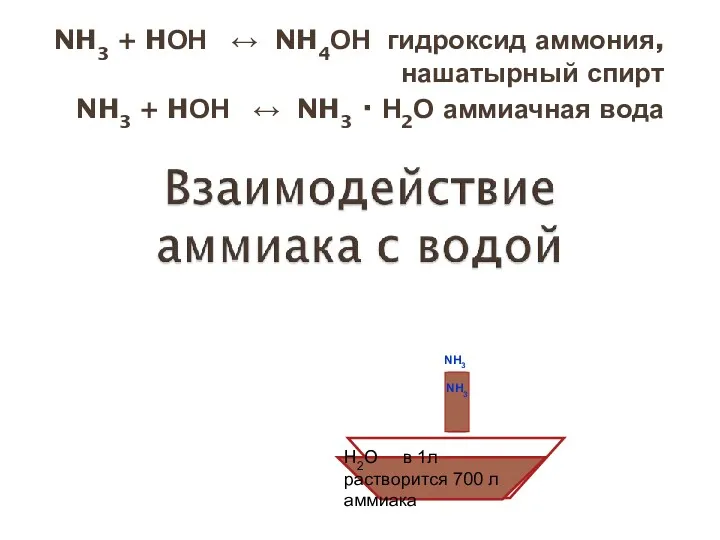
- 13. Свойства физические Строение Легче воздуха Хорошо растворим в воде H2O в 1л растворится 700 л аммиака
- 14. 1.Взаимодействие с водой. Действие водного раствора аммиака на индикаторы. 2.Взаимодействие с кислотами 3.Окисление: без катализатора; с
- 16. NH3 + HОН ↔ NH4ОН гидроксид аммония, нашатырный спирт NH3 + HОН ↔ NH3 · Н2О
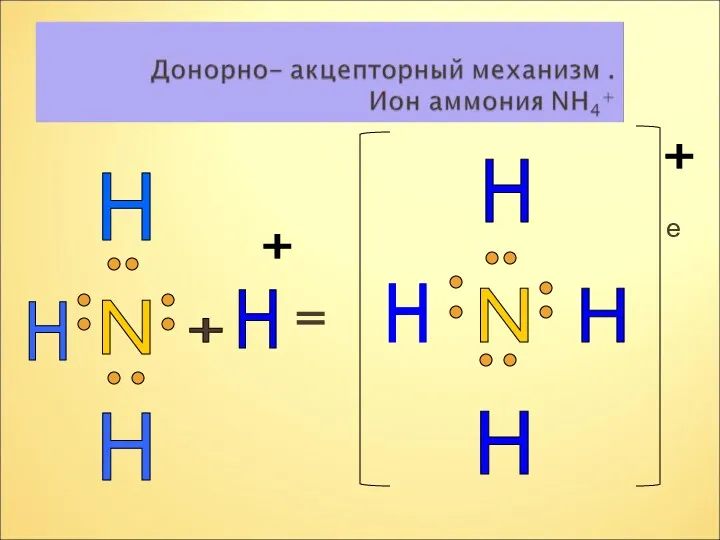
- 17. е N H H H H + = N H H H H + +
- 18. Растворение аммиака в воде и в кислотах – процесс химический, в основе которого лежит способность молекул
- 19. NH3 + HCl → NH4Cl. хлорид аммония( нашатырь) 2 NH3 + H2SO4 → (NH4)2 SO4 сульфат
- 20. 1. В отсутствии катализатора NH3 + O2 → N2 + H2O 4NH3 + 3O2 = 2N2
- 21. Аммиак не горит на воздухе, но в чистом кислороде или в присутствии катализатора аммиак хорошо окисляется,
- 22. . CuSO4 +2NaOH→Cu(OH)2+Na2SO4 4NH3+ Cu(OH)2→[Cu(NH3)4](OH)2
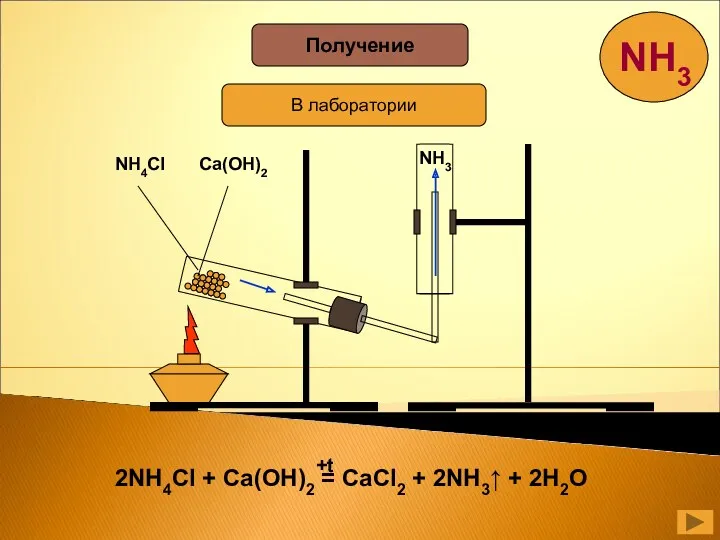
- 23. Получение В лаборатории NH4Cl Ca(OH)2 NH3
- 24. N + 3H = 2NH 2 2 3
- 25. Применение Свойства
- 26. Чтоб продукты не пропали Вам поможет аммиак, И растениям, конечно, Аммиак совсем не враг. Если обморок
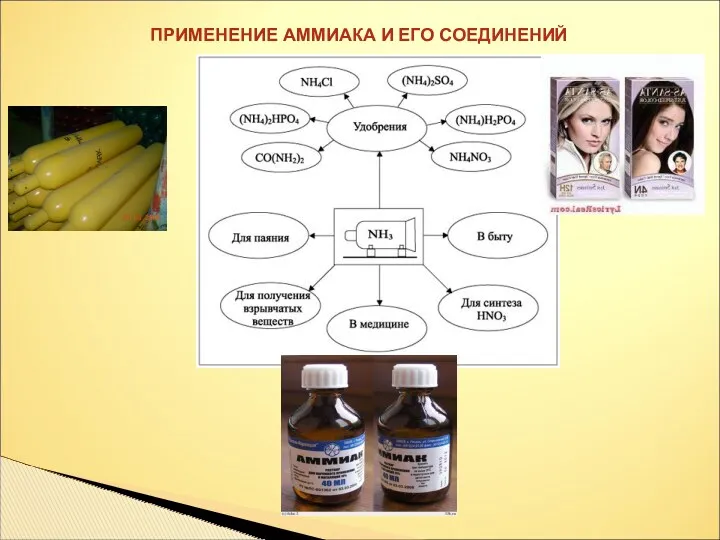
- 27. ПРИМЕНЕНИЕ АММИАКА И ЕГО СОЕДИНЕНИЙ
- 30. Нельзя прикасаться к разлитому веществу, это может вызвать болезненный ожог кожных покровов. При утечке аммиака важно
- 31. Контроль по теме «Аммиак».Что узнали? 1 уровень 1)Аммиак ____________ растворяется в воде. 2)Раствор аммиака в воде
- 32. 2 уровень 1)Молекула аммиака имеет неподелённую электронную пару: А. Одну Б. Две В. Три Г. Пять
- 33. Аммиак Газообразный Хорошорастворим Восстановитель при горении Образующий соль нашатырь Поражающий слизистые оболочки Поражает растения
- 35. Скачать презентацию












2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/587095/slide-21.jpg)








 Химическая технология органических веществ
Химическая технология органических веществ Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії
Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії Введение в органическую химию
Введение в органическую химию Матеріали на основі аерогелів: класифікація, підходи до синтезу та сфери застосування
Матеріали на основі аерогелів: класифікація, підходи до синтезу та сфери застосування Термодинамика химических процессов
Термодинамика химических процессов Простые вещества – неметаллы. Аллотропия
Простые вещества – неметаллы. Аллотропия Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Каучук. Применение
Каучук. Применение Распространенность химических элементов на земле и в космосе
Распространенность химических элементов на земле и в космосе Естери. Класифікація та номенклатура естерів
Естери. Класифікація та номенклатура естерів Галогенопроизводные. Растворимость, общие закономерности
Галогенопроизводные. Растворимость, общие закономерности Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку
Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку Определение витамина “С” в продуктах питания с помощью иодометрии
Определение витамина “С” в продуктах питания с помощью иодометрии Periodic Table and Trends
Periodic Table and Trends Природные источники углеводородов
Природные источники углеводородов Классификация химических реакций
Классификация химических реакций Structural revision of (+)-uprolide F diacetate confirmed by asymmetric total synthesis
Structural revision of (+)-uprolide F diacetate confirmed by asymmetric total synthesis Карбоновые кислоты. Строение
Карбоновые кислоты. Строение Фосфор. 9 класс
Фосфор. 9 класс Агрегатные состояния вещества
Агрегатные состояния вещества Природные источники углеводородов и топливные ресурсы Западной Сибири
Природные источники углеводородов и топливные ресурсы Западной Сибири Осадительное титрование. Меркуриметрия
Осадительное титрование. Меркуриметрия Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева Химический элемент. Электронное строение атома
Химический элемент. Электронное строение атома Тест по ККЛС тема: Анализ воды очищенной и для инъекций
Тест по ККЛС тема: Анализ воды очищенной и для инъекций Значение периодического закона Д. И. Менделеева
Значение периодического закона Д. И. Менделеева 6-я группа элементов. 9 класс
6-я группа элементов. 9 класс Простые вещества металлы
Простые вещества металлы