Содержание
- 2. Предмет органической химии Химия – наука о веществах, их строении, свойствах и превращениях. Органическая химия –
- 3. История органики До начала XIX века все вещества делились на минеральные и органические. FeS2 FeS2
- 4. История органики Фридрих Вёлер В период с 1824 по 1828 год смог впервые синтезировать органическое вещество
- 5. Герои начала органической химии Адольф Вильгельм Герман Кольбе Пьер Эжен Марселен Бертло Александр Михайлович Бутлеров
- 6. Герои начала органической химии Одно из отличий органической и неорганической химии заключается в том, что большинство
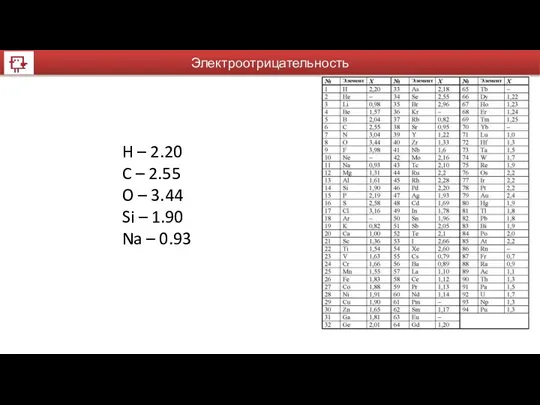
- 7. Электроотрицательность H – 2.20 C – 2.55 O – 3.44 Si – 1.90 Na – 0.93
- 8. Органическое вещество Органическое вещество – такое вещество, в химический состав которого входит углерод, водород, кислород, азот,
- 9. Специфика органических соединений На данный момент известно около 50 тыс. неорганических соединений и около 20 млн.
- 10. Специфика органических соединений На данный момент известно около 50 тыс. неорганических соединений и около 20 млн.
- 11. Связи в органических соединениях Атомы углерода могут образовывать одинарные, двойные, тройные связи между друг другом и
- 12. Структурные формулы
- 13. Теория химического строения органических соединений ГЛАВА 2. Введение в органическую химию. Теория химического строения вещества.
- 14. Теория химического строения органических соединений Александр Михайлович Бутлеров Как наука органическая химия сформировалась только в середине
- 15. Положения: Молекулы любого вещества имеют определённое химическое строение, то есть атомы элементов, входящих в молекулу, соединяются
- 16. Формулы органических соединений Молекулы химических соединений изображают при помощи формул, которые содержат атомы всех входящих в
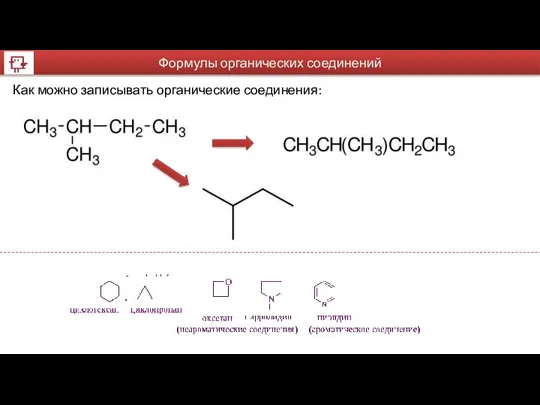
- 17. Формулы органических соединений Как можно записывать органические соединения:
- 18. Формулы органических соединений Как изобразить неподеленную электронную пару?
- 19. Изомерия Изомеры – вещества имеющие одинаковые молекулярные формулы, но различный порядок связей в молекулах, т.е. различные
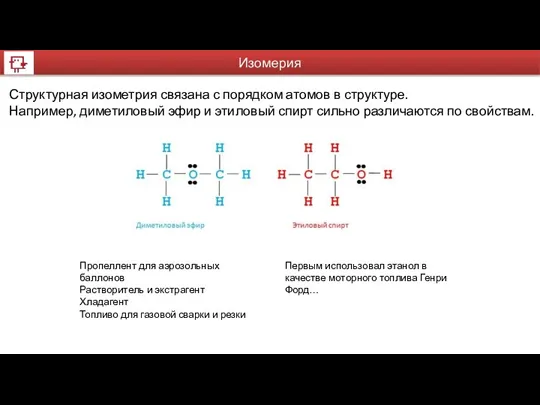
- 20. Структурная изометрия связана с порядком атомов в структуре. Например, диметиловый эфир и этиловый спирт сильно различаются
- 21. ГЛАВА 3. Классификация органических соединений
- 22. Классификация органических соединений Большое количество органических соединений (ок. 20 млн.) требует четкой и логичной классификации для
- 23. Углеродный скелет – последовательность химически связанных между собой атомов углерода. Функциональные группы – представляют собой атомы
- 24. В зависимости от строения углеродного скелета органические соединения делятся на ациклические и циклические. Ациклические соединения –
- 25. В зависимости от строения углеродного скелета органические соединения делятся на ациклические и циклические. Ациклические соединения –
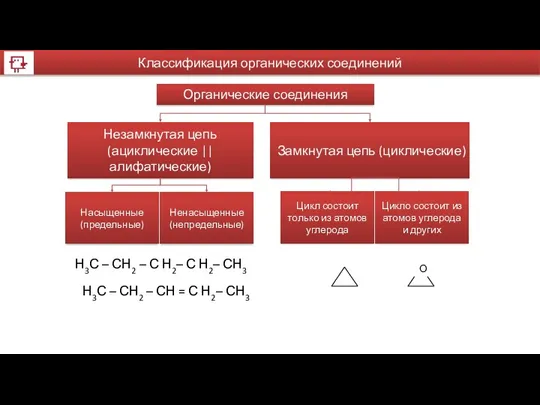
- 26. Органические соединения Незамкнутая цепь (ациклические || алифатические) Замкнутая цепь (циклические) Ненасыщенные (непредельные) Насыщенные (предельные) Цикло состоит
- 27. Классификация органических соединений
- 28. Теория химического строения органических соединений ГЛАВА 3. Классификация органических соединений
- 29. 8 21.09.2016 Природа связей в органических соединениях Образование устойчивой внешней оболочки Ковалентная связь Ионная связь
- 30. 9 21.09.2016 Природа связей в органических соединениях Образование устойчивой внешней оболочки Ковалентная связь Ионная связь Ионная
- 31. 10 21.09.2016 Природа связей в органических соединениях Образование устойчивой внешней оболочки Ковалентная связь Ионная связь Ковалентная
- 32. 11 21.09.2016 Природа связей в органических соединениях Ковалентная связь Каждый из атомов предоставляет по одному электрону.
- 33. 12 21.09.2016 Формы орбиталей
- 34. 13 21.09.2016 Природа связей в органических соединениях Химическая связь, образующееся в результате перекрывания орбиталей вдоль линии,
- 35. 14 21.09.2016 Природа связей в органических соединениях Химические связи, образующиеся в результате перекрывания орбиталей в двух
- 36. 15 21.09.2016 Природа связей в органических соединениях Сколько π- и Ϭ –связей в соединениях: Метан CH4
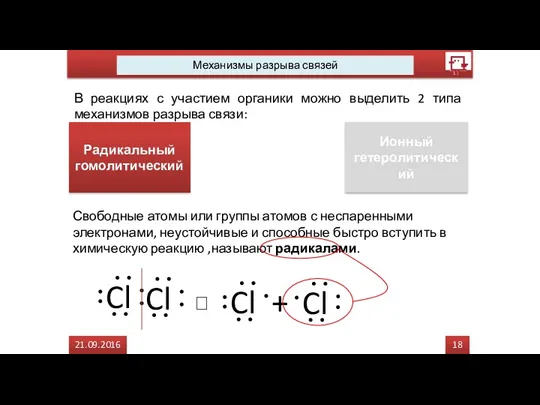
- 37. 15 21.09.2016 Механизмы разрыва связей В реакциях с участием органики можно выделить 2 типа механизмов разрыва
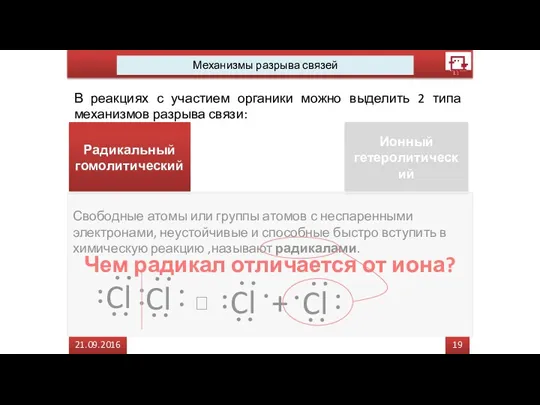
- 38. 17 21.09.2016 Механизмы разрыва связей В реакциях с участием органики можно выделить 2 типа механизмов разрыва
- 39. 18 21.09.2016 Механизмы разрыва связей В реакциях с участием органики можно выделить 2 типа механизмов разрыва
- 40. 19 21.09.2016 Механизмы разрыва связей В реакциях с участием органики можно выделить 2 типа механизмов разрыва
- 41. 20 21.09.2016 Механизмы разрыва связей В реакциях с участием органики можно выделить 2 типа механизмов разрыва
- 42. 21 21.09.2016 Механизмы разрыва связей В реакциях с участием органики можно выделить 2 типа механизмов разрыва
- 44. Скачать презентацию



































 Кислород
Кислород Силикатное производство
Силикатное производство Карбоновые кислоты
Карбоновые кислоты Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Определите положение в ПСХЭ элементов
Определите положение в ПСХЭ элементов Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 Диеновые углеводороды CnH2n-2
Диеновые углеводороды CnH2n-2 Кристаллическая решетка
Кристаллическая решетка Мыла: прошлое, настоящее, будущее
Мыла: прошлое, настоящее, будущее Кремний и его соединения
Кремний и его соединения Минералы. Классификация минералов
Минералы. Классификация минералов Застосування неметалів
Застосування неметалів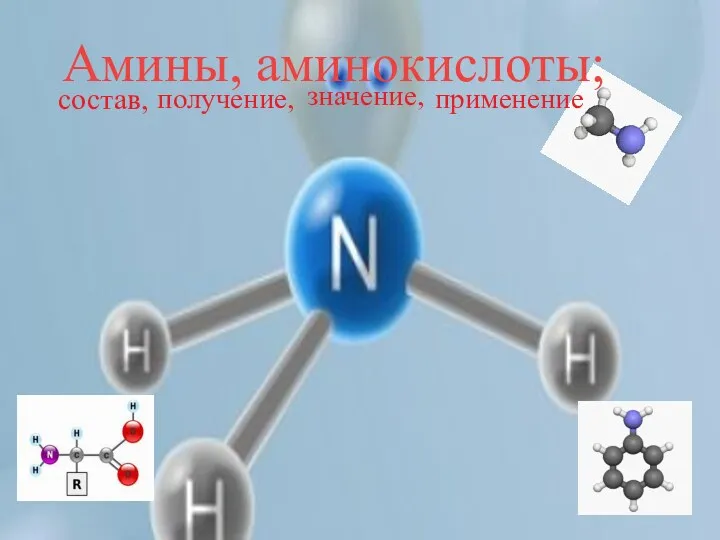 Амины, аминокислоты; состав, получение, значение, применение
Амины, аминокислоты; состав, получение, значение, применение Спектроскопія ямр на ядрах 13с
Спектроскопія ямр на ядрах 13с Типы химических реакций
Типы химических реакций Титан
Титан Соединения кремния
Соединения кремния Переработка угля
Переработка угля Классификация химических элементов. 8 класс
Классификация химических элементов. 8 класс Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16)
Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16) Классы органических и неорганических веществ
Классы органических и неорганических веществ Строение атома. Лекция 2
Строение атома. Лекция 2 Углеводы. Моносахариды. Лекция 5
Углеводы. Моносахариды. Лекция 5 Теории химической кинетики. Лекция 4
Теории химической кинетики. Лекция 4 Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Кислородсодержащие органические соединения. Лабораторная работа
Кислородсодержащие органические соединения. Лабораторная работа Основные сырьевые материалы для производства портландцемента
Основные сырьевые материалы для производства портландцемента Періодична система хімічних елементів
Періодична система хімічних елементів