Содержание
- 2. План: Классификация, номенклатура и строение кислот. Физические и химические свойства. Применение.
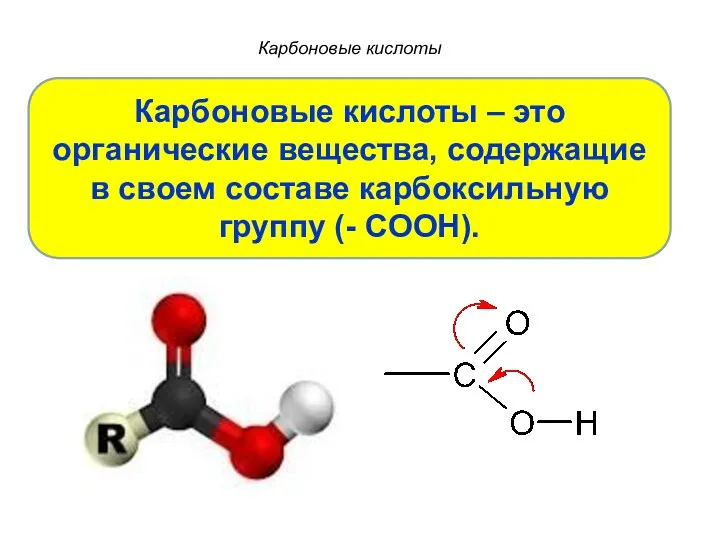
- 3. Карбоновые кислоты Карбоновые кислоты – это органические вещества, содержащие в своем составе карбоксильную группу (- COOH).
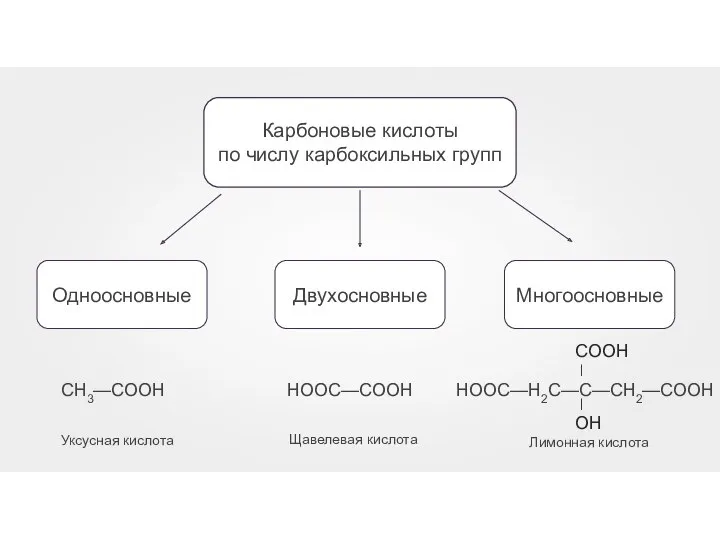
- 4. Карбоновые кислоты по числу карбоксильных групп НООС—СООН Щавелевая кислота СН3—СООН Уксусная кислота Лимонная кислота
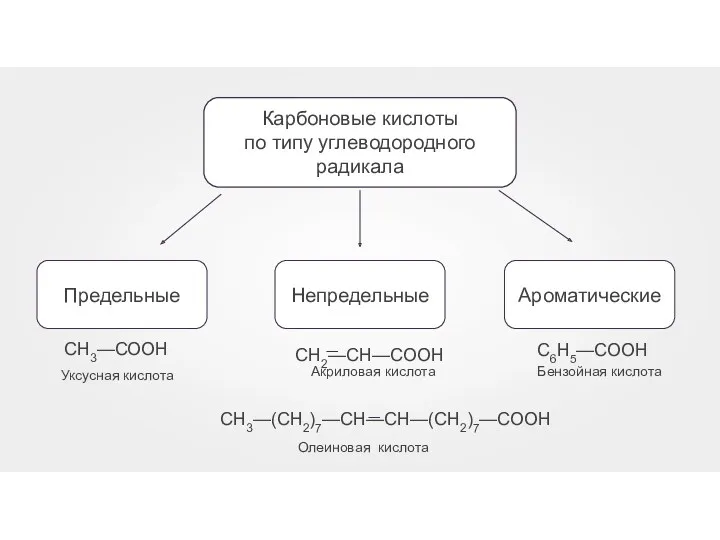
- 5. Карбоновые кислоты по типу углеводородного радикала Акриловая кислота СН3—СООН Бензойная кислота Олеиновая кислота C6H5—COOH Уксусная кислота
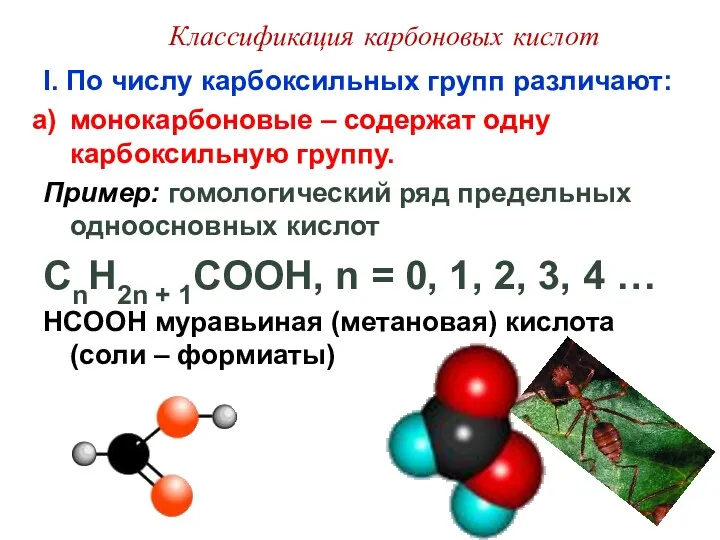
- 6. Классификация карбоновых кислот I. По числу карбоксильных групп различают: монокарбоновые – содержат одну карбоксильную группу. Пример:
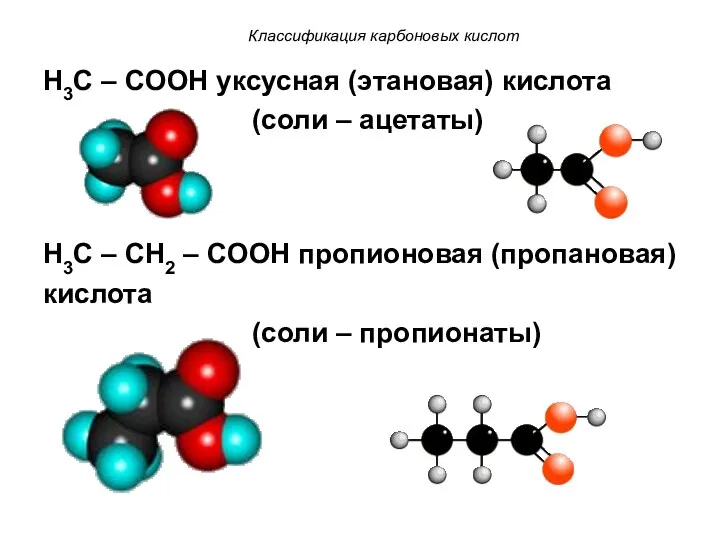
- 7. Классификация карбоновых кислот H3C – COOH уксусная (этановая) кислота (соли – ацетаты) H3C – CH2 –
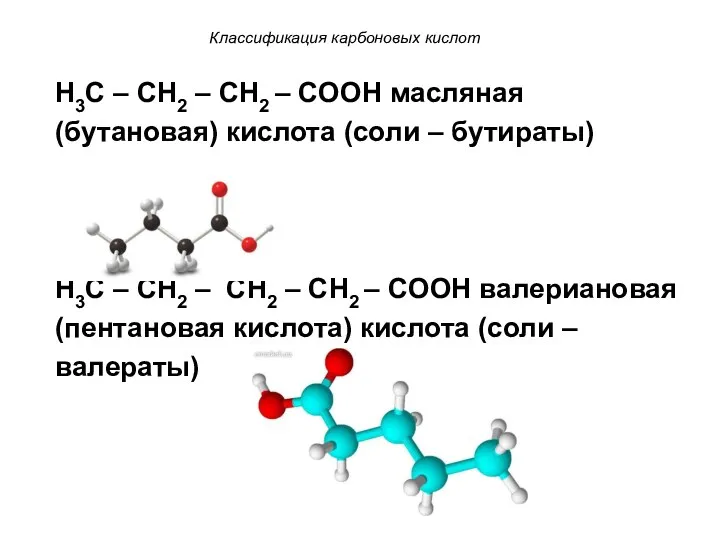
- 8. Классификация карбоновых кислот H3C – CH2 – CH2 – COOH масляная (бутановая) кислота (соли – бутираты)
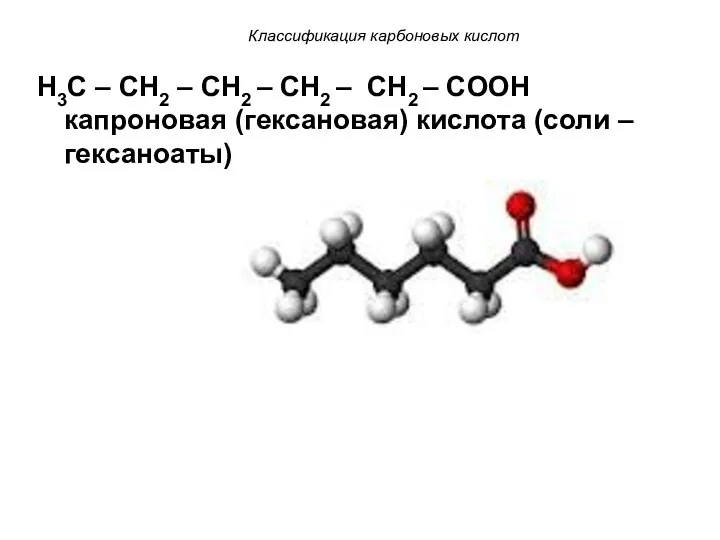
- 9. Классификация карбоновых кислот H3C – CH2 – CH2 – CH2 – CH2 – COOH капроновая (гексановая)
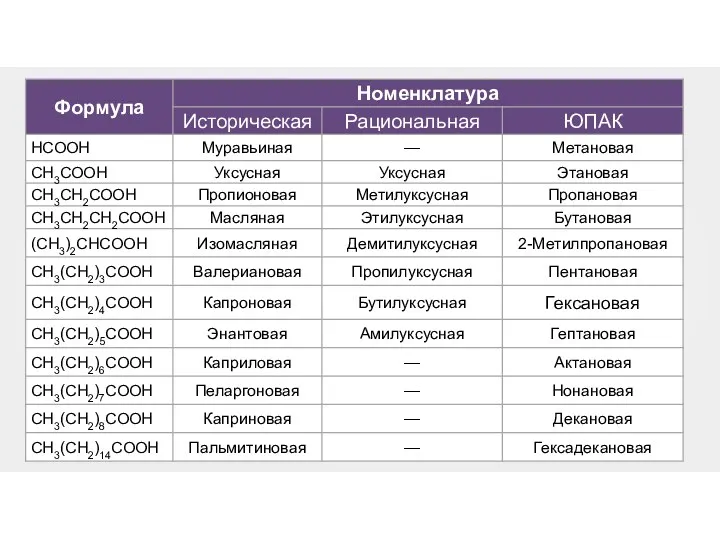
- 10. HCOOH Муравьиная (метановая) - формиат CH3COOH Уксусная (этановая) - ацетат CH3CH2COOH Пропионовая (пропановая) - пропионат CH3(CH2)2COOH
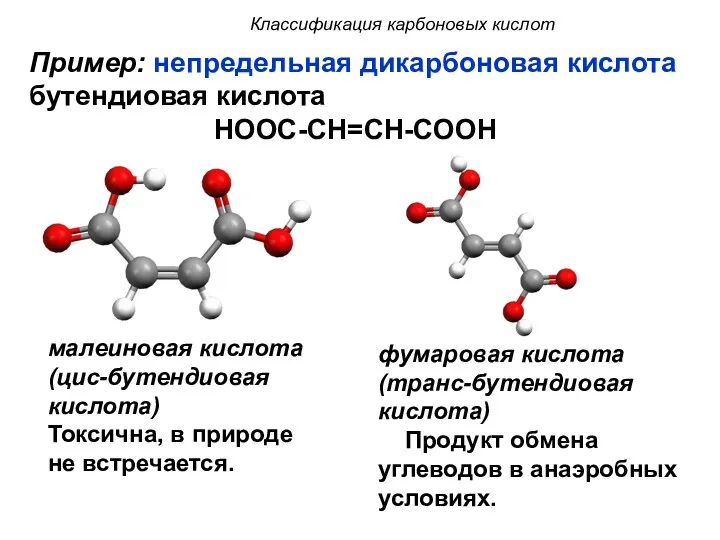
- 11. Классификация карбоновых кислот b) поликарбоновые – содержат в своем составе две и более карбоксильные группы. Пример:
- 12. малеиновая кислота (цис-бутендиовая кислота) Токсична, в природе не встречается. фумаровая кислота (транс-бутендиовая кислота) Продукт обмена углеводов
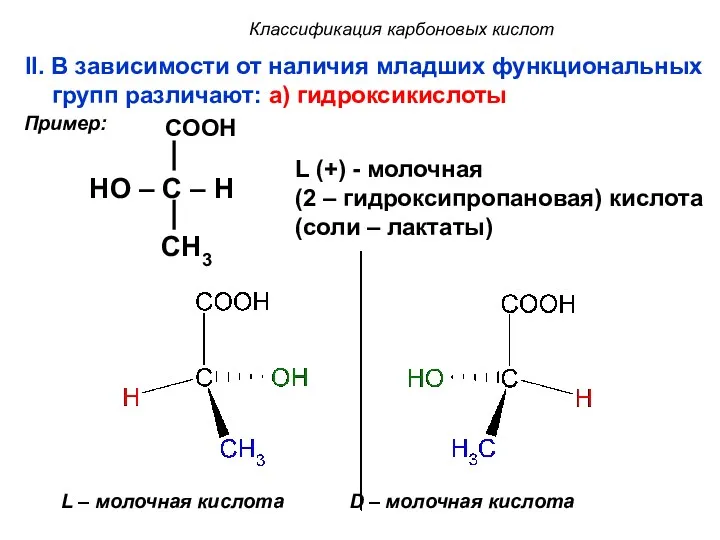
- 13. Классификация карбоновых кислот II. В зависимости от наличия младших функциональных групп различают: a) гидроксикислоты COOH HO
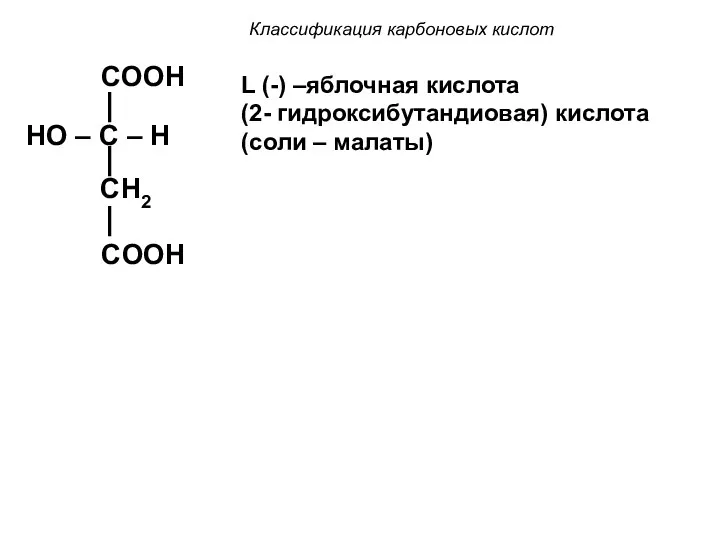
- 14. Классификация карбоновых кислот COOH HO – C – H CH2 COOH L (-) –яблочная кислота (2-
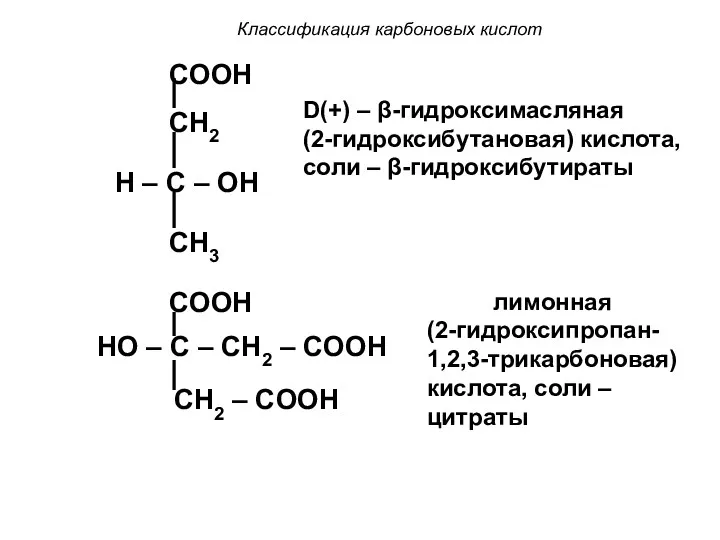
- 15. Классификация карбоновых кислот COOH CH2 H – C – OH CH3 D(+) – β-гидроксимасляная (2-гидроксибутановая) кислота,
- 16. Классификация карбоновых кислот Гидроксикислоты являются, как правило, твёрдыми телами. Рацемическая молочная кислота может быть жидкой (т.
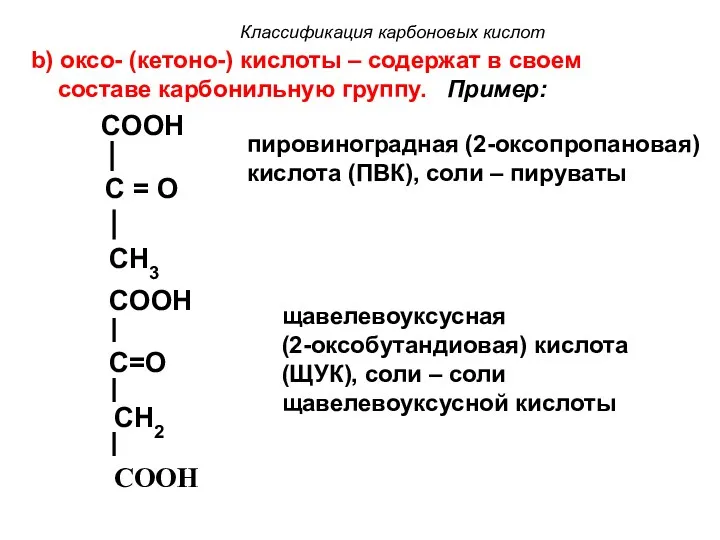
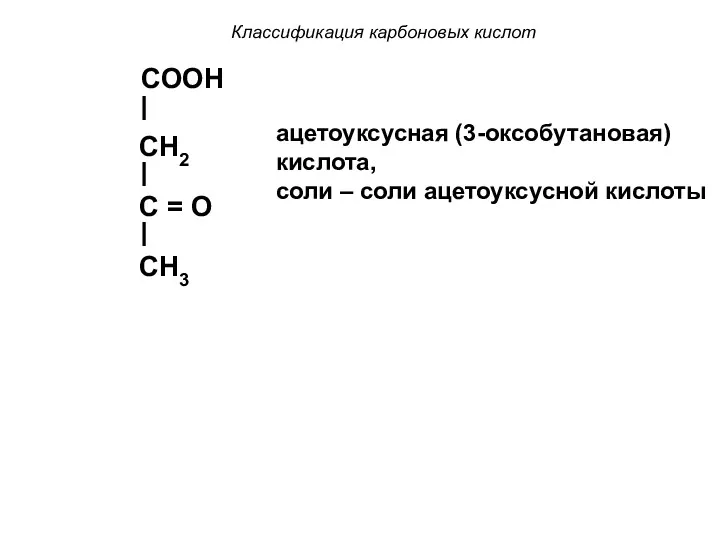
- 17. Классификация карбоновых кислот b) оксо- (кетоно-) кислоты – содержат в своем составе карбонильную группу. Пример: COOH
- 18. Классификация карбоновых кислот COOH CH2 C = O CH3 ацетоуксусная (3-оксобутановая) кислота, cоли – соли ацетоуксусной
- 19. Классификация карбоновых кислот III. Особую группу составляют высшие (жирные) карбоновые кислоты (ВЖК); входят в состав липидов.
- 20. b) непредельные. Пример: C17H33COOH – олеиновая кислота (одна двойная связь), C17H31COOH – линолевая кислота (две двойных
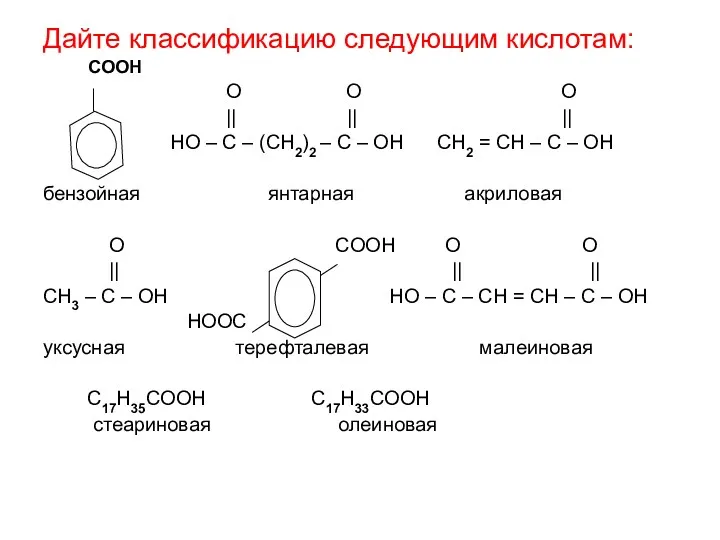
- 21. Дайте классификацию следующим кислотам: COOH O O O || || || HO – C – (CH2)2
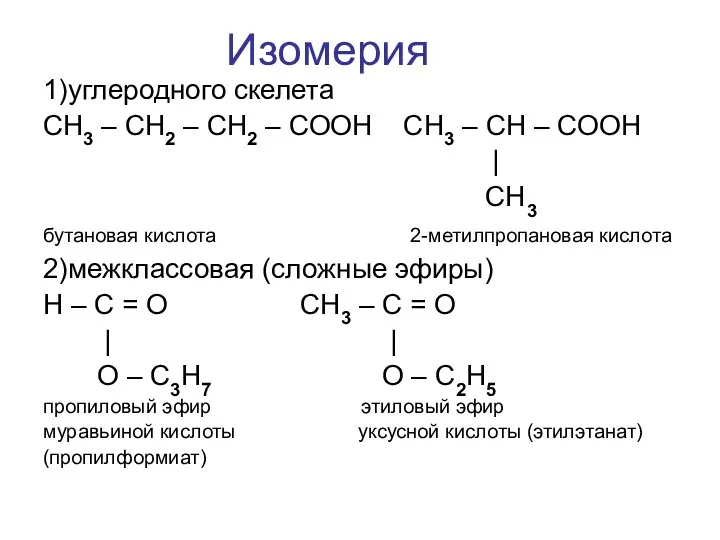
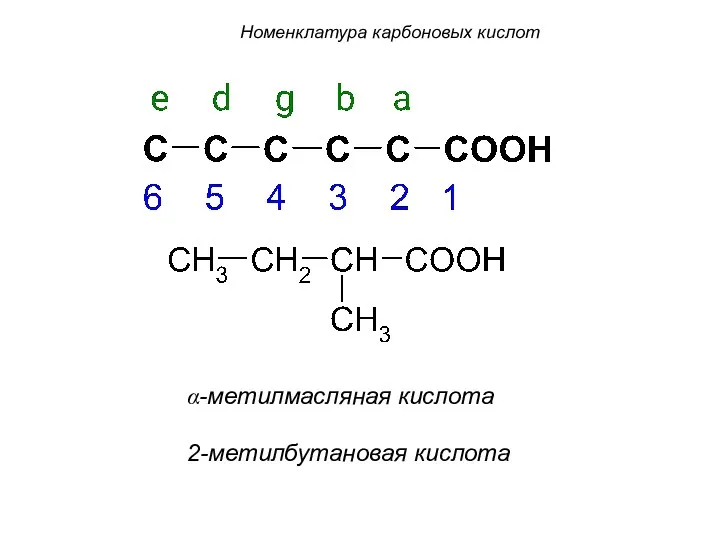
- 23. Изомерия 1)углеродного скелета CH3 – CH2 – CH2 – COOH CH3 – CH – COOH |
- 24. α-метилмасляная кислота 2-метилбутановая кислота Номенклатура карбоновых кислот
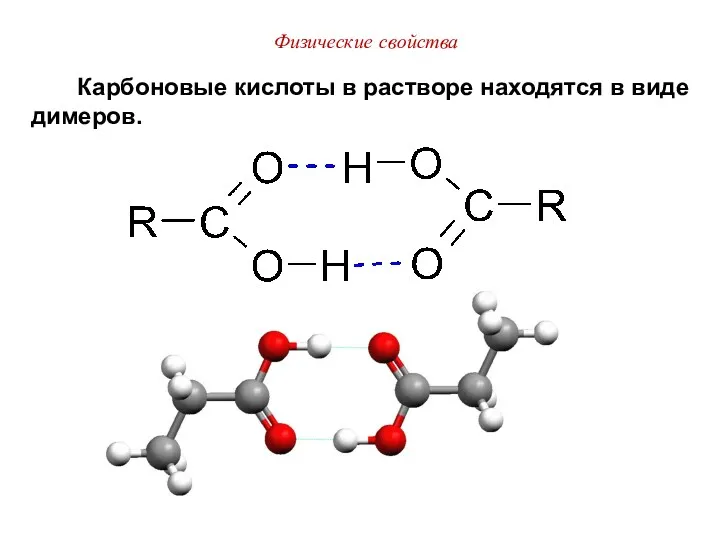
- 25. Физические свойства Карбоновые кислоты в растворе находятся в виде димеров.
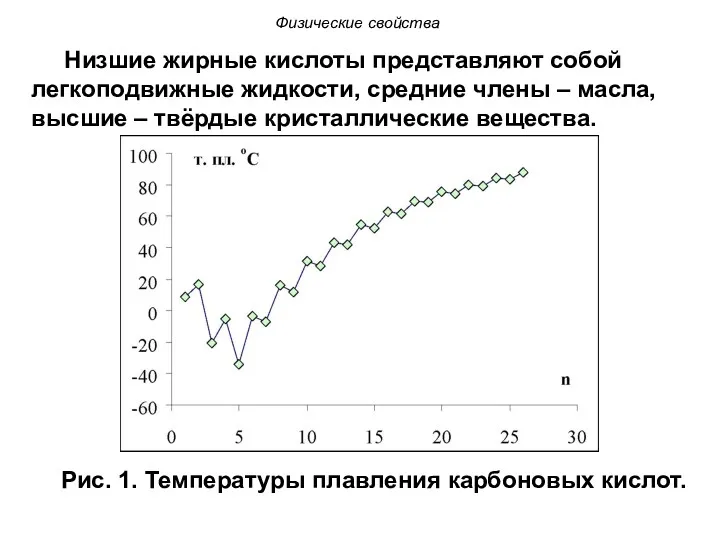
- 26. Физические свойства Низшие жирные кислоты представляют собой легкоподвижные жидкости, средние члены – масла, высшие – твёрдые
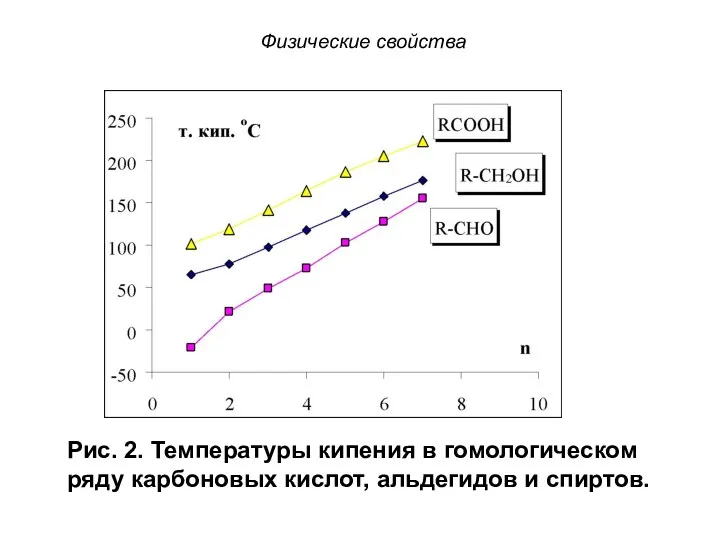
- 27. Физические свойства Рис. 2. Температуры кипения в гомологическом ряду карбоновых кислот, альдегидов и спиртов.
- 28. Физические свойства Первые члены гомологического ряда карбоновых кислот обладают резким запахом, средние – прогорклым, неприятным, например,
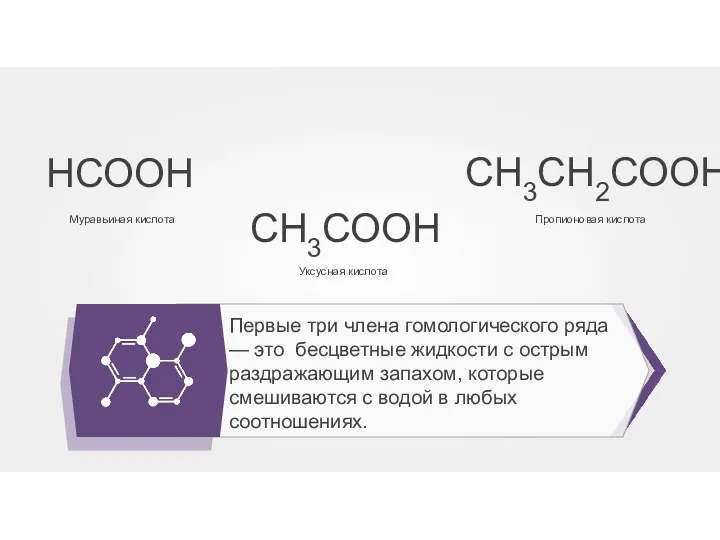
- 29. Муравьиная кислота Уксусная кислота Масляная кислота НСООН СН3СООН CH3CH2CH2СООН
- 30. Первые три члена гомологического ряда — это бесцветные жидкости с острым раздражающим запахом, которые смешиваются с
- 31. Начиная с масляной кислоты — маслянистые жидкости, плохо растворимые в воде, с приятным запахом. Масляная кислота
- 32. Высшие кислоты, начиная с декановой, — твёрдые соединения, лишённые запаха. Декановая кислота CH3(CH2)8СООН
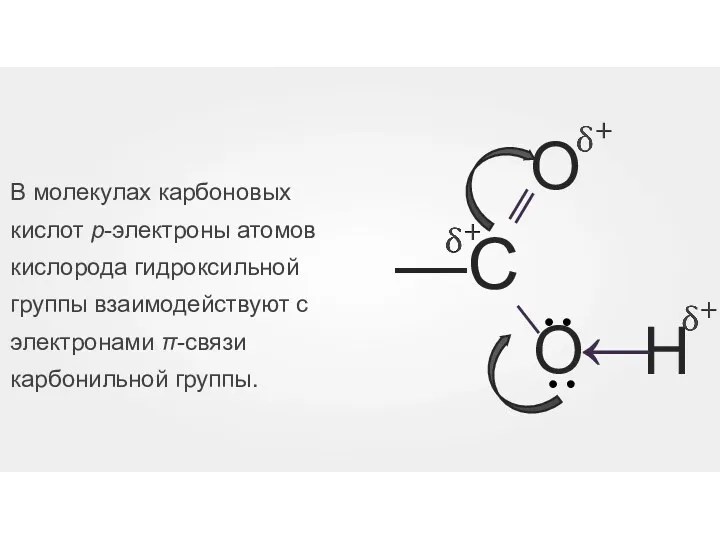
- 33. В молекулах карбоновых кислот p-электроны атомов кислорода гидроксильной группы взаимодействуют с электронами π-связи карбонильной группы.
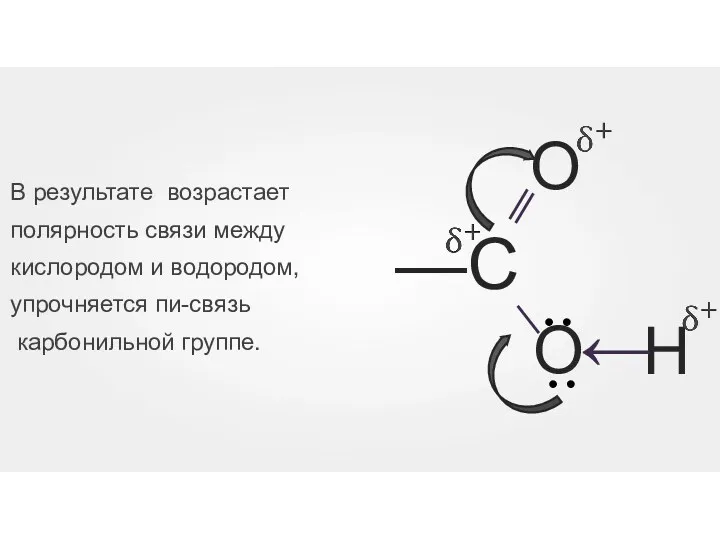
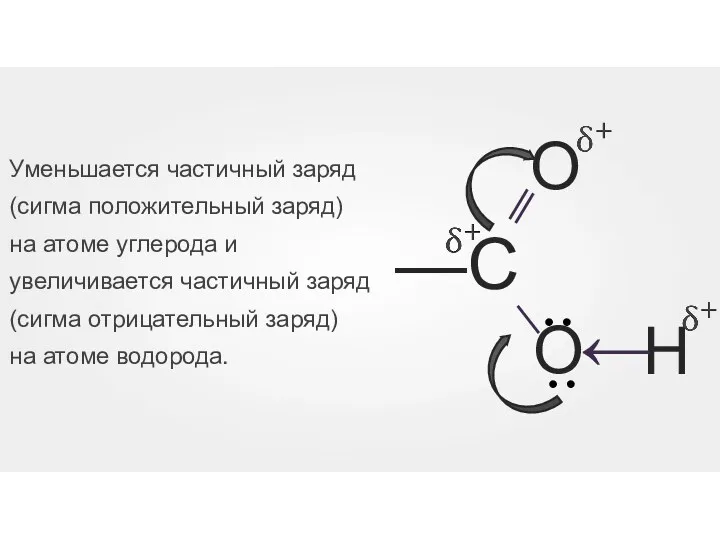
- 34. В результате возрастает полярность связи между кислородом и водородом, упрочняется пи-связь карбонильной группе.
- 35. Уменьшается частичный заряд (сигма положительный заряд) на атоме углерода и увеличивается частичный заряд (сигма отрицательный заряд)
- 36. Химические свойства I.Карбоновые кислоты обладают свойствами, характерными для минеральных кислот. 1.Из-за смещения электронной плотности от гидроксильной
- 37. 2. Они реагируют с активными металлами. 2СH3COOH + Mg → (CH3COO)2Mg + H2↑ 3. Реагируют с
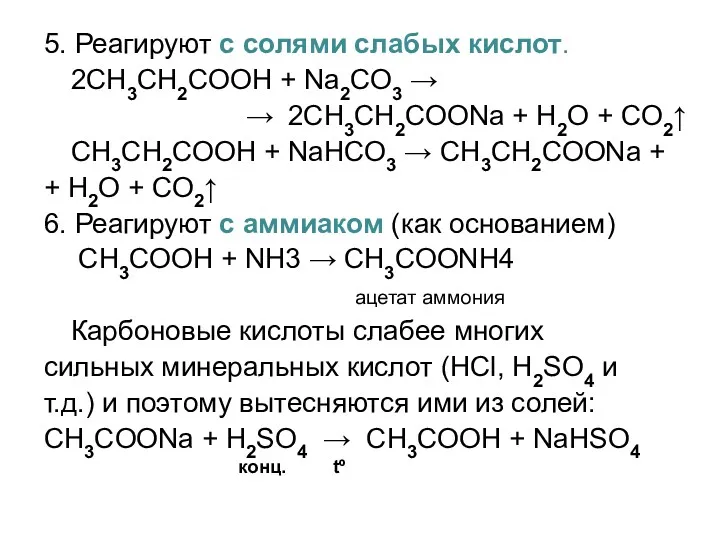
- 38. 5. Реагируют с солями слабых кислот. 2СH3CH2COOH + Na2CO3 → → 2CH3CH2COONa + H2O + CO2↑
- 39. II.Специфические свойства карбоновых кислот. 7. Реакция этерификации (реакция Фишера-Шпайера, 1895) (или нуклеофильного замещения (SN)у sp2-гибридизованного атома
- 40. Реакция образования сложного эфира из кислоты и спирта называется реакцией этерификации. этилацетат CH3СООCH2CH3
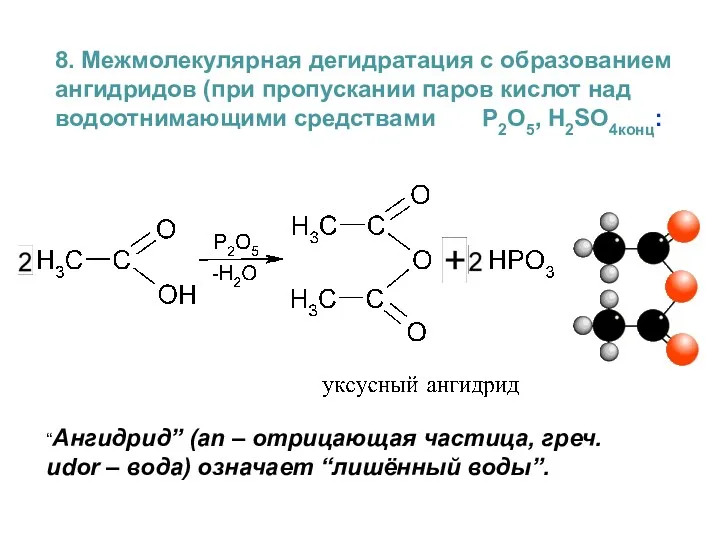
- 41. 8. Межмолекулярная дегидратация с образованием ангидридов (при пропускании паров кислот над водоотнимающими средствами P2O5, H2SO4конц: “Ангидрид”
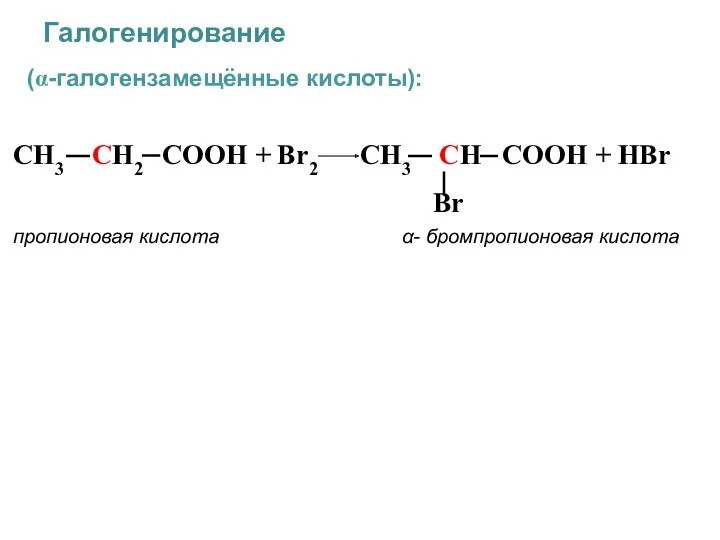
- 42. 9. Галогенирование. У карбоновых кислот под влиянием карбоксильной группы Увеличивается подвижность атомов водорода, стоящих при атоме
- 43. (α-галогензамещённые кислоты): CH3 CH2 COOH + Br2 CH3 CH COOH + HBr Br пропионовая кислота α-
- 44. СН3СООН → СH2СlCООН → → СНCl2СООН → СCl3CООН Уксусная кислота Монохлоруксусная кислота Дихлоруксусная кислота Трихлоруксусная кислота
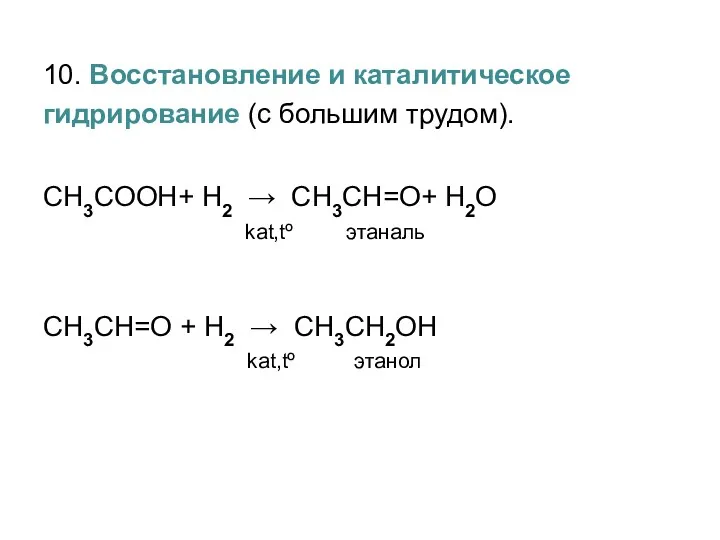
- 45. 10. Восстановление и каталитическое гидрирование (с большим трудом). СH3COOH+ H2 → СH3CH=O+ H2O kat,tº этаналь СH3CH=O
- 46. 11. Реакции декарбоксилирования In vitro реакции протекают при нагревании, in vivo с участием ферментов декарбоксилаз. а)
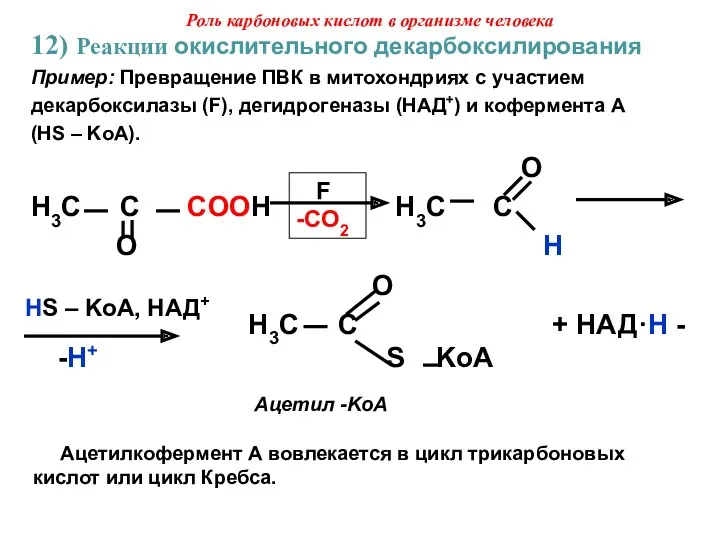
- 47. 12) Реакции окислительного декарбоксилирования Пример: Превращение ПВК в митохондриях с участием декарбоксилазы (F), дегидрогеназы (НАД+) и
- 48. 13. Окисление карбоновых кислот В организме карбоновые кислоты окисляются в основном за счёт т.н. b-окисления. Кроме
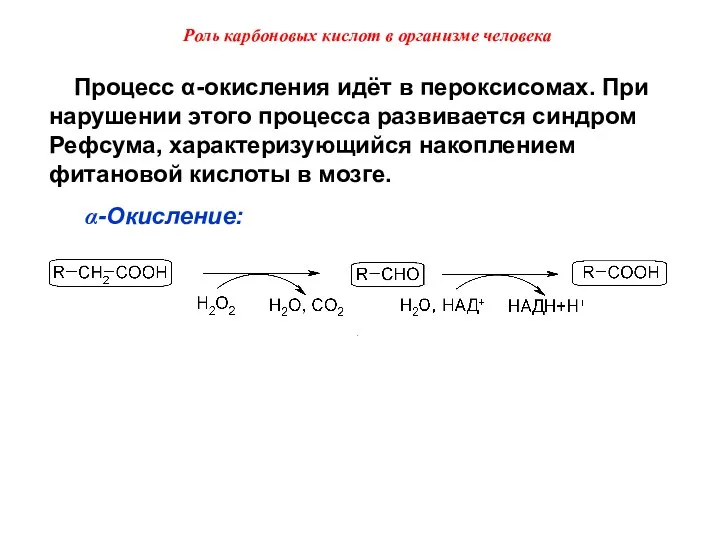
- 49. Процесс α-окисления идёт в пероксисомах. При нарушении этого процесса развивается синдром Рефсума, характеризующийся накоплением фитановой кислоты
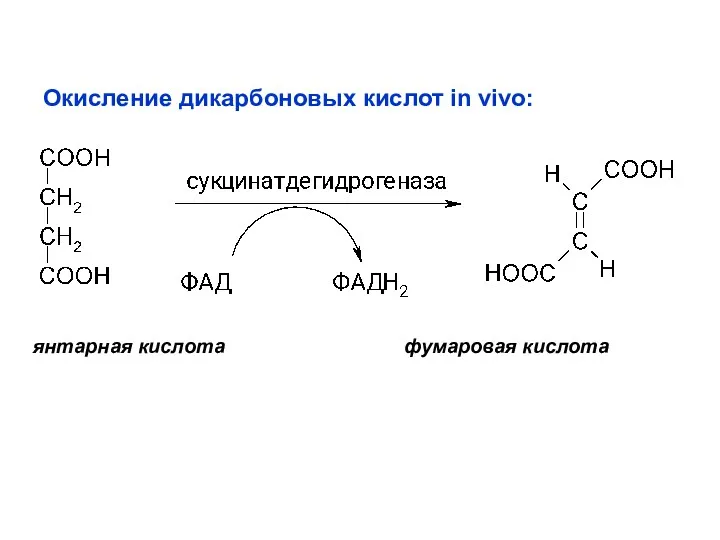
- 50. Окисление дикарбоновых кислот in vivo: янтарная кислота фумаровая кислота
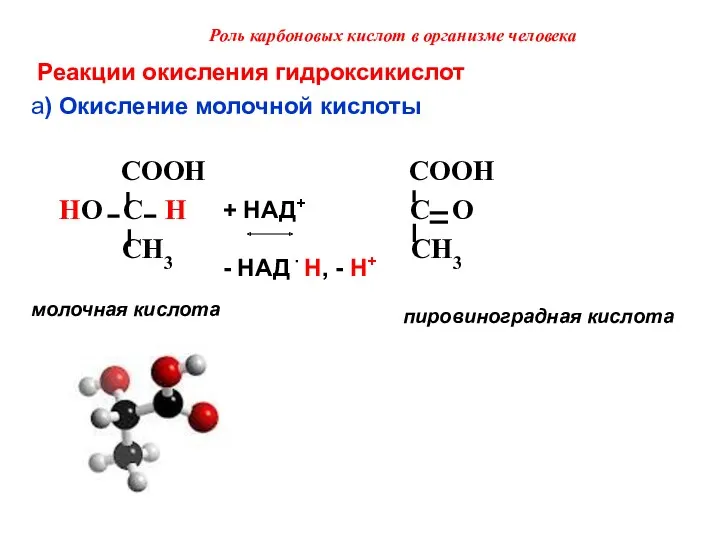
- 51. Роль карбоновых кислот в организме человека Реакции окисления гидроксикислот a) Окисление молочной кислоты COOH COOH HO
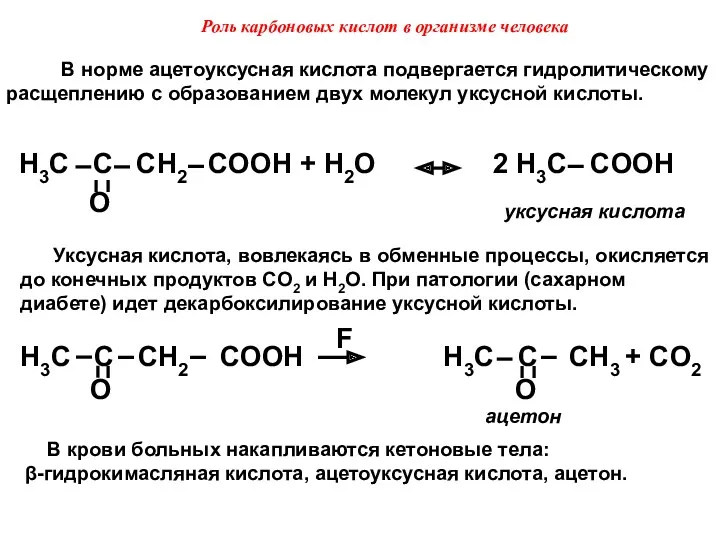
- 52. H3C C CH2 COOH + H2O 2 H3C COOH O В норме ацетоуксусная кислота подвергается гидролитическому
- 53. Около 80% почечных камней образуется из оксалата кальция. Роль карбоновых кислот в организме человека
- 54. Благодаря работам выдающегося шведского химика Карла Вильгельма Шееле к концу XVIII в стало известно около десяти
- 55. Йенс Якоб Берцелиус в 1814 году определил состав уксусной кислоты. Й.Я. Берцелиус 1779–1848 гг.
- 56. В 1845 году немецким химиком Адольфом Вильгельмом Германом Кольбе был осуществлён полный синтез уксусной кислоты из
- 57. Уксусную кислоту в промышленности получают окислением уксусного альдегида, который в свою очередь синтезируют гидратацией ацетилена по
- 58. Получение карбоновых кислот
- 59. 2RCHO + О2 → 2RCOOH Окисление альдегидов (в промышленности) t
- 60. Лабораторные окислители Ag2О KMnO4 K2Cr2O7 Оксид серебра Перманганат калия Дихромат калия
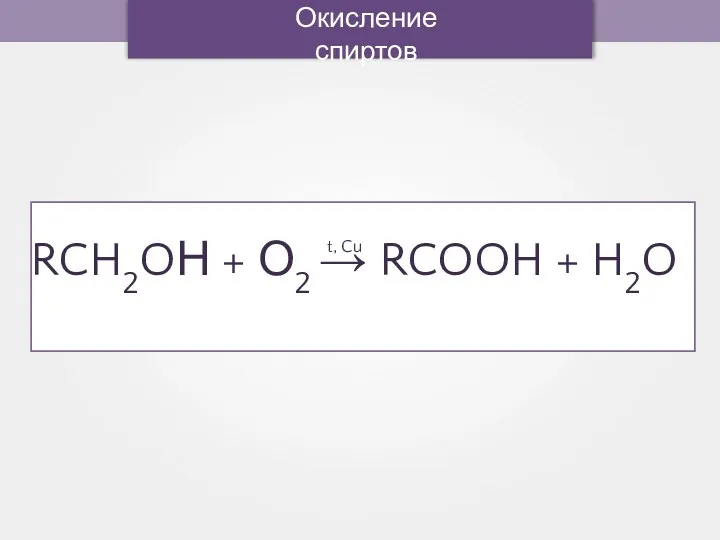
- 61. Окисление спиртов
- 62. Окисление предельных углеводородов
- 63. Окисление непредельных углеводородов
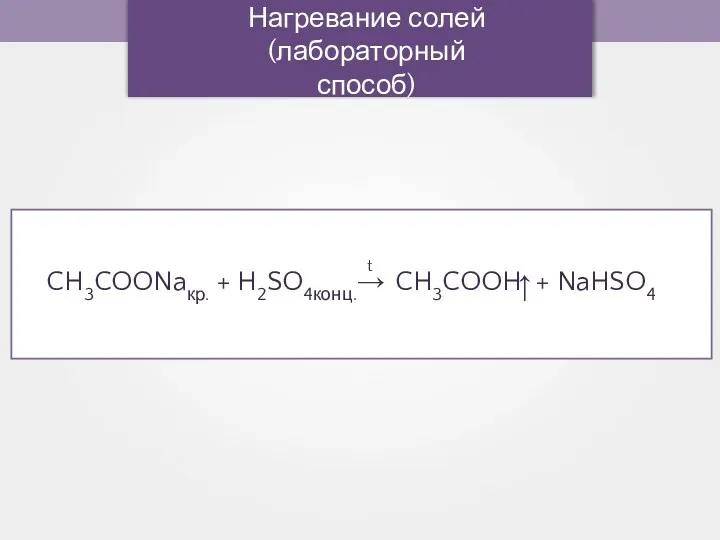
- 64. Нагревание солей (лабораторный способ) →
- 65. Хорошо знакомая людям с древности уксусная кислота получается при сухой перегонке. СН3COOH
- 66. Применение карбоновых кислот и её проиводных Салициловая кислота применяется в медицине в виде спиртовых растворов и
- 67. Метилсалицилат: Используется как противовоспалительное, анальгетическое средство наружно (в виде мазей). Применение карбоновых кислот и её производных
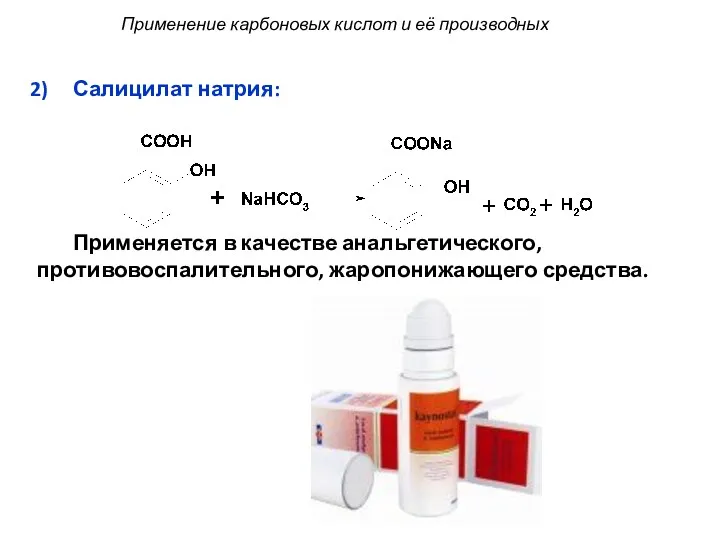
- 68. Салицилат натрия: Применяется в качестве анальгетического, противовоспалительного, жаропонижающего средства. Применение карбоновых кислот и её производных
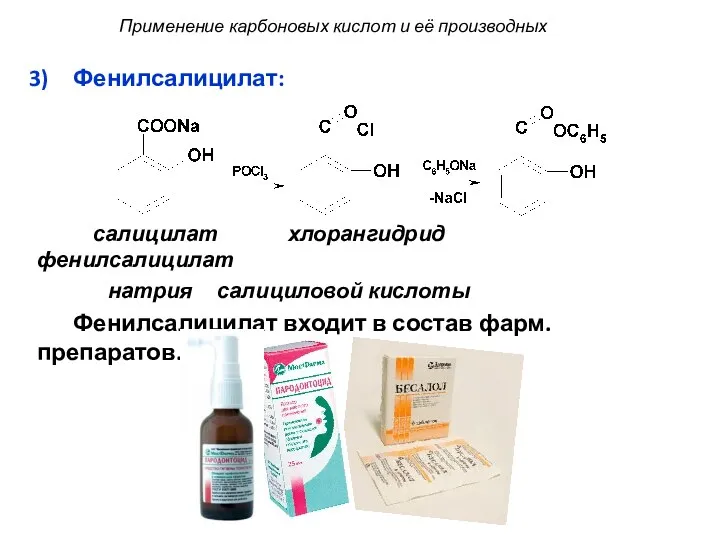
- 69. Фенилсалицилат: салицилат хлорангидрид фенилсалицилат натрия салициловой кислоты Фенилсалицилат входит в состав фарм. препаратов. Применение карбоновых кислот
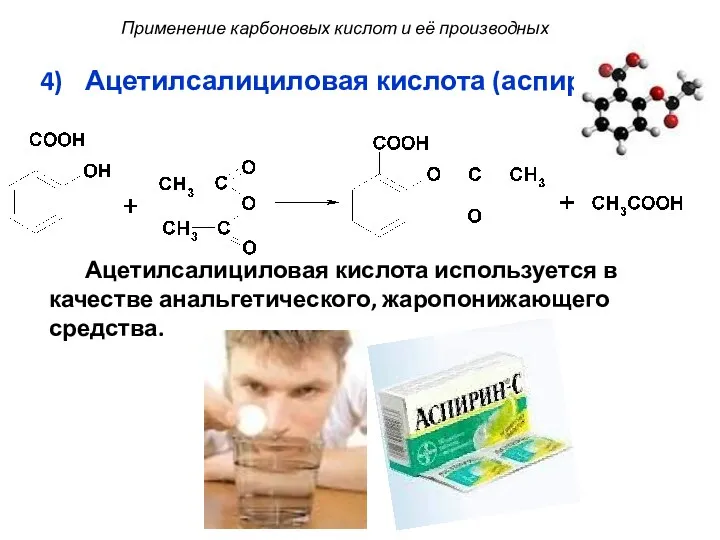
- 70. Ацетилсалициловая кислота (аспирин): Ацетилсалициловая кислота используется в качестве анальгетического, жаропонижающего средства. Применение карбоновых кислот и её
- 71. НСООН
- 72. СН3СООН
- 73. (НООС-СН(ОН)-СН2-СООН) Яблочная кислота
- 74. Винная кислота НООС - СН(ОН) - СН(ОН) - СООН
- 75. . Молочная кислота CH3CH(OH)COOH
- 76. Щавель Ревень Щавелевая кислота НООС - СООН
- 77. Лимонная кислота
- 78. Бензойная кислота С6Н5 - СООН
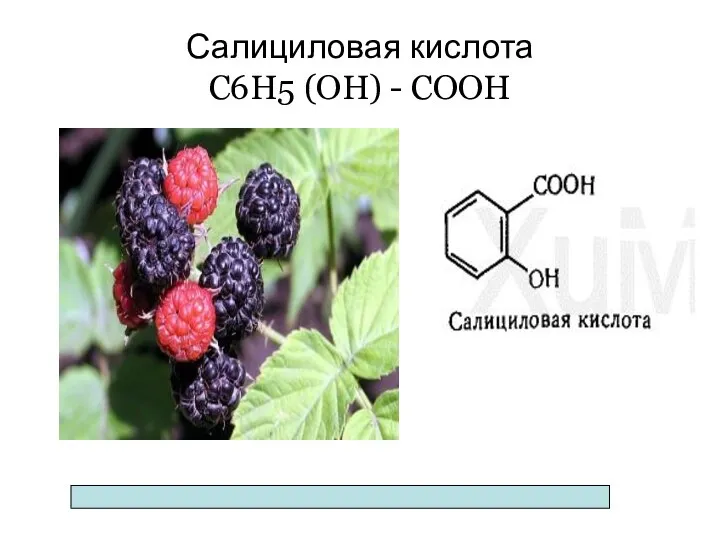
- 79. Салициловая кислота С6Н5 (ОН) - СООН
- 81. Скачать презентацию





































 Строение атома. Периодичность свойств элементов и их соединений
Строение атома. Периодичность свойств элементов и их соединений Нітрати – токсичні речовини
Нітрати – токсичні речовини Химическая связь. Природа химической связи
Химическая связь. Природа химической связи Минералы свинца
Минералы свинца Уравнения химических реакций
Уравнения химических реакций Карбоновые кислоты. (10 класс)
Карбоновые кислоты. (10 класс) Кремний және оның қосылыстары
Кремний және оның қосылыстары Щелочноземельные металлы
Щелочноземельные металлы Формы минералов и их агрегатов
Формы минералов и их агрегатов Ізомери у природі
Ізомери у природі Биологически активные вещества и их содержание в лекарственных растениях
Биологически активные вещества и их содержание в лекарственных растениях Ионоселективные электроды
Ионоселективные электроды Методы очистки нефтяных фракций
Методы очистки нефтяных фракций Двойные молибдаты и вольфраматы РЗЭ как лазерные матрицы. Свойства, методы выращивания
Двойные молибдаты и вольфраматы РЗЭ как лазерные матрицы. Свойства, методы выращивания Теоретические основы и технология первичной переработки нефти. Тема 4
Теоретические основы и технология первичной переработки нефти. Тема 4 Энтальпия. Тепловой эффект химической реакции. 11 класс
Энтальпия. Тепловой эффект химической реакции. 11 класс Основы химической термодинамики
Основы химической термодинамики Старение полимеров. Процессы, протекающие при старении полимеров
Старение полимеров. Процессы, протекающие при старении полимеров Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас
Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас Растворы. Лекция №5
Растворы. Лекция №5 Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)
Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.) Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Физико-химические методы анализа: электрохимические, спектральные (оптические) и хроматографические
Физико-химические методы анализа: электрохимические, спектральные (оптические) и хроматографические Алюминий. 9 класс
Алюминий. 9 класс Металлы в природе. Получение
Металлы в природе. Получение Неделя химии в МБОУ Андреевская ООШ
Неделя химии в МБОУ Андреевская ООШ Элементы VА-группы
Элементы VА-группы Циклические углеводороды. Циклоалканы
Циклические углеводороды. Циклоалканы