Содержание
- 2. Химическая термодинамика – это наука, которая изучает условия устойчивости химических систем и законы, по которым системы
- 3. Системы бывают: открытые, в которых существует обмен энергией и веществом с окружающей средой; закрытые, в которых
- 4. Состояние системы описывают с помощью макроскопических параметров. Параметры бывают: внутренние, которые определяются только координатами тел системы,
- 5. Состояние системы описывается также с помощью термодинамических функций, которые зависят от параметров. Различают: функции состояния, которые
- 6. Если хотя бы один из параметров системы меняется со временем, то говорят, что в системе происходит
- 7. Первое исходное положение, или основной постулат термодинамики: Любая изолированная система с течением времени приходит в равновесное
- 8. Любая система характеризуется запасом внутренней энергии (U) внутренней энергия зависит от количества вещества, строения и состояния
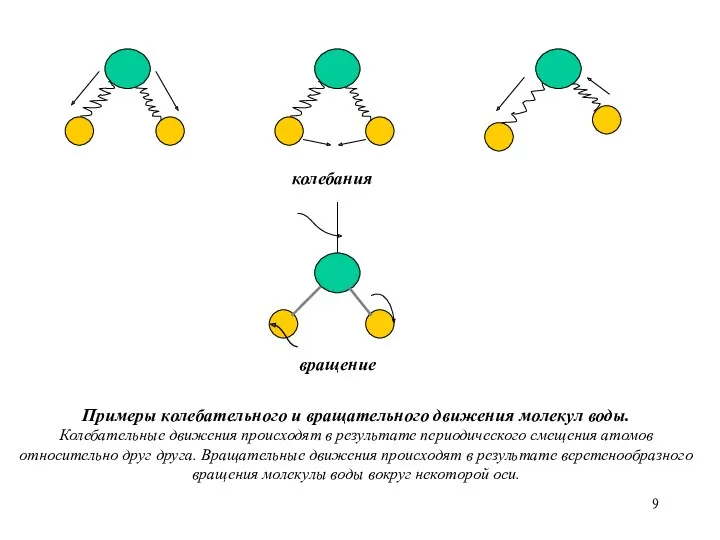
- 9. колебания вращение Примеры колебательного и вращательного движения молекул воды. Колебательные движения происходят в результате периодического смещения
- 10. Поскольку система может обмениваться с окружающей средой энергией в форме теплоты (Q) и работы (А), то
- 11. Первый закон (первое начало) термодинамики: Энергия изолированной системы постоянна. В неизолированной системе энергия может изменяться за
- 12. Если система совершает только работу расширения: A = F·h; F=p·S; A=p·S·h=p·ΔV, где А – работа, совершаемая
- 13. таким образом, ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ может быть сформулирован так: Энергия не может ни создаваться, ни исчезать,
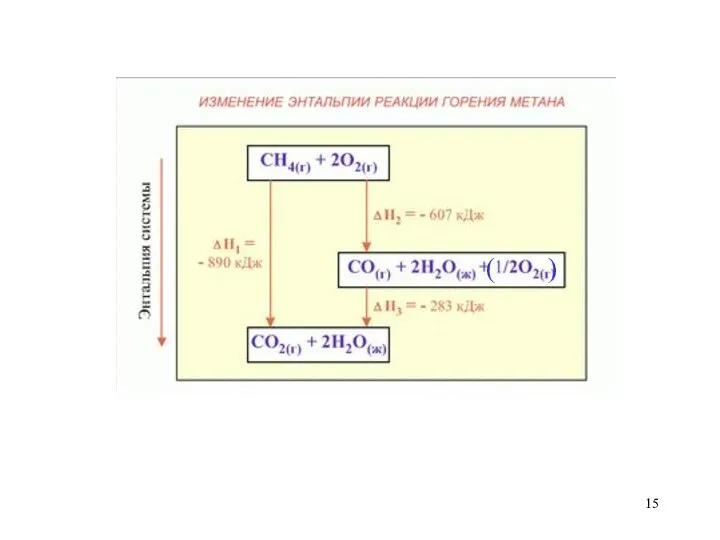
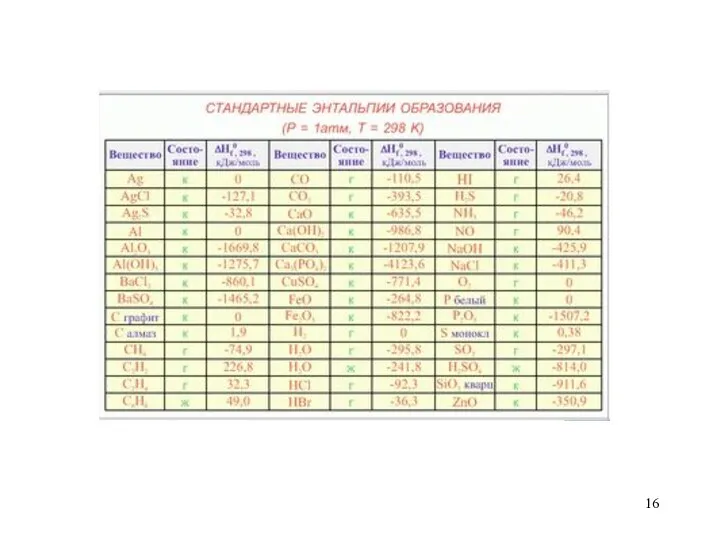
- 14. Изменение энергии системы при протекании в ней химической реакции при условии, что система не совершает никакой
- 15. ( )
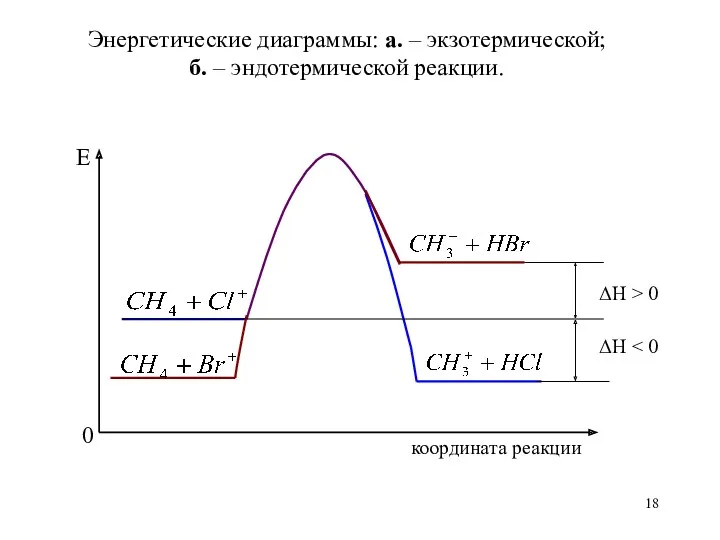
- 17. Если в результате реакции теплота выделяется, т.е. энтальпия системы понижается (ΔН называется экзотермической Если в результате
- 18. Энергетические диаграммы: а. – экзотермической; б. – эндотермической реакции. Е координата реакции 0 ΔН > 0
- 19. закон Гесса: Тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но
- 21. Следствия из закона Гесса: Тепловой эффект химической реакции по замкнутому контуру равен нулю; Если из одинаковых
- 22. 3. Если из различных начальных состояний системы переходят к одинаковым конечным состояниям, то разность между тепловыми
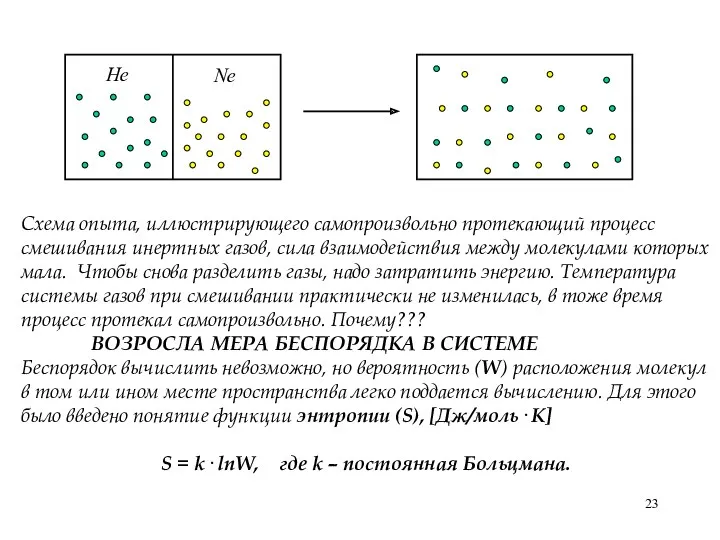
- 23. Не Ne Схема опыта, иллюстрирующего самопроизвольно протекающий процесс смешивания инертных газов, сила взаимодействия между молекулами которых
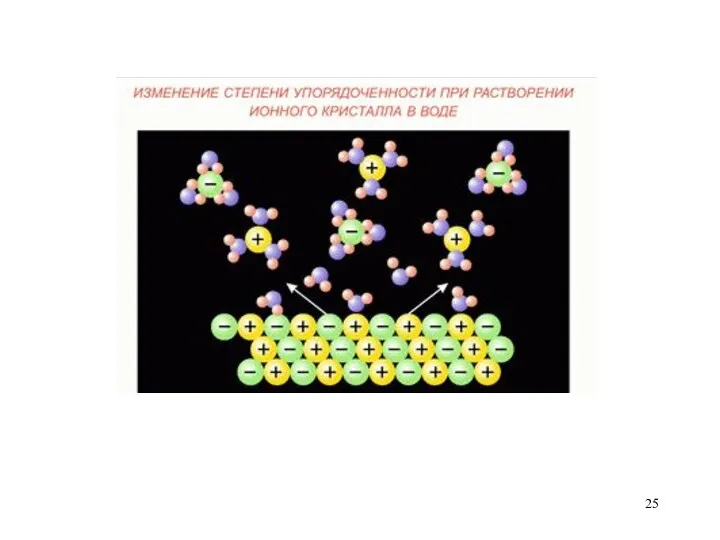
- 24. Второй закон термодинамики: В изолированной системе самопроизвольно совершаются только те процессы, которые приводят к увеличению энтропии.
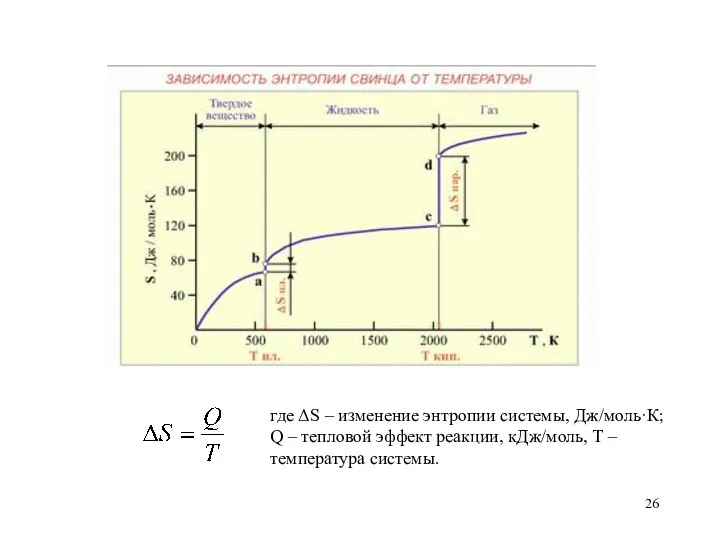
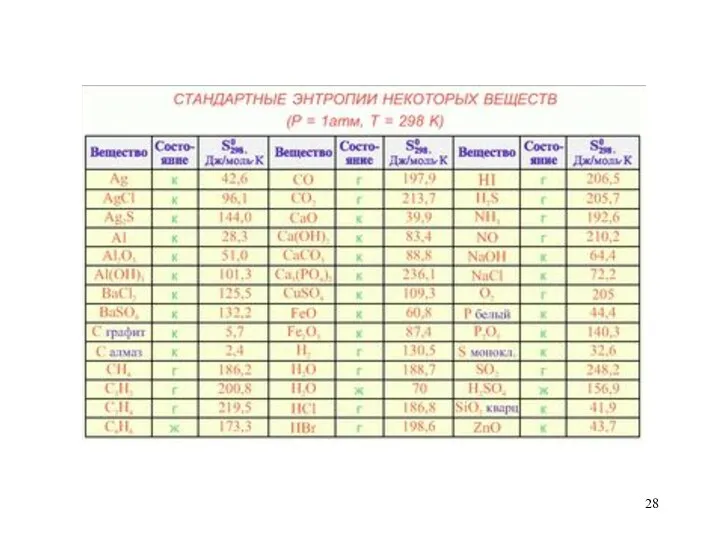
- 26. где ΔS – изменение энтропии системы, Дж/моль·К; Q – тепловой эффект реакции, кДж/моль, Т – температура
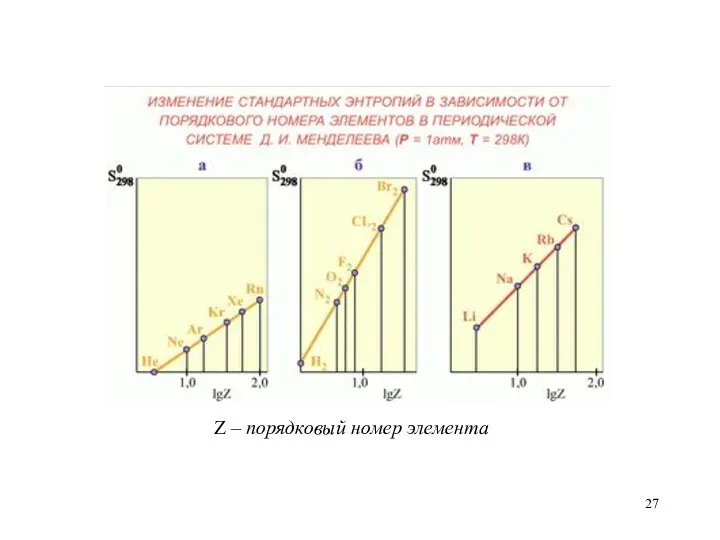
- 27. Z – порядковый номер элемента
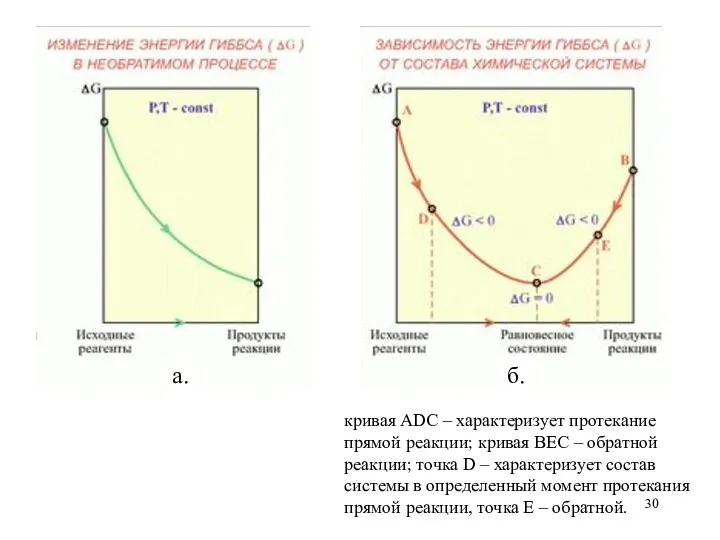
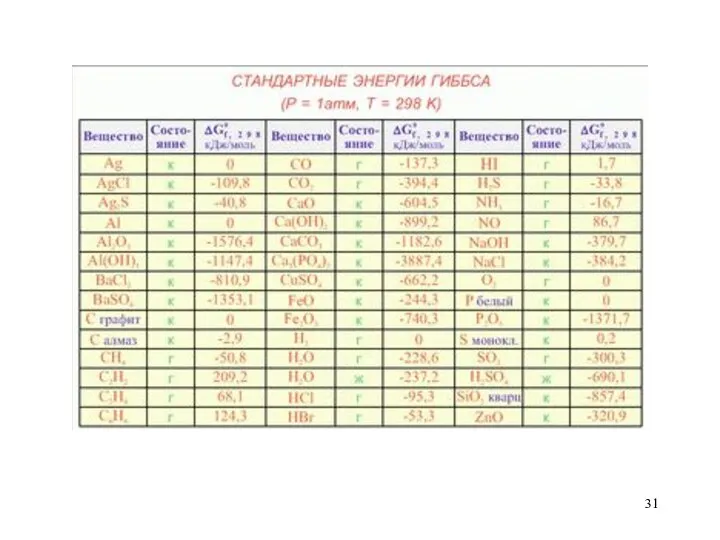
- 29. Для того, чтобы предсказать будет протекать реакция или нет, было введено понятие изобарно- изотермического потенциала (энергии
- 30. кривая АDC – характеризует протекание прямой реакции; кривая ВЕС – обратной реакции; точка D – характеризует
- 33. Скачать презентацию



















 Хлороводород и соляная кислота
Хлороводород и соляная кислота Типы химических связей
Типы химических связей Химия и проблемы экологии. Кислотные дожди
Химия и проблемы экологии. Кислотные дожди Общие химические свойства металлов. Химия. 11 класс
Общие химические свойства металлов. Химия. 11 класс Biomass Feedstocks
Biomass Feedstocks Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Тканые армирующие материалы
Тканые армирующие материалы Щелочные металлы
Щелочные металлы Электрохимический ряд напряжений металлов. Свойства металлов
Электрохимический ряд напряжений металлов. Свойства металлов Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия Донорно-акцепторний механізм утворення ковалентного зв’язку
Донорно-акцепторний механізм утворення ковалентного зв’язку Карбоновые кислоты (часть 1)
Карбоновые кислоты (часть 1) Total Synthesis of (−) - Lepenine
Total Synthesis of (−) - Lepenine Периодический закон химических элементов Д. И. Менделеева и периодическая система
Периодический закон химических элементов Д. И. Менделеева и периодическая система Сложные эфиры. Жиры
Сложные эфиры. Жиры Геохимия. Геохимическая система элементов
Геохимия. Геохимическая система элементов Изучение и развитие понятия химический элемент в школьном курсе химии
Изучение и развитие понятия химический элемент в школьном курсе химии Главная подгруппа V группы..Азот
Главная подгруппа V группы..Азот Щелочи
Щелочи Валентність хімічних елементів
Валентність хімічних елементів Реакционная способность соединений с карбонильной группой
Реакционная способность соединений с карбонильной группой Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Тірі ағзада жүретін процесстер – физика-химиялық интерпретация
Тірі ағзада жүретін процесстер – физика-химиялық интерпретация Разделение неоднородных систем
Разделение неоднородных систем Органическая химия. Ацетилен
Органическая химия. Ацетилен Стекло, его виды и классификация
Стекло, его виды и классификация Окислительные свойства серной и азотной кислот
Окислительные свойства серной и азотной кислот Алкины
Алкины