Содержание
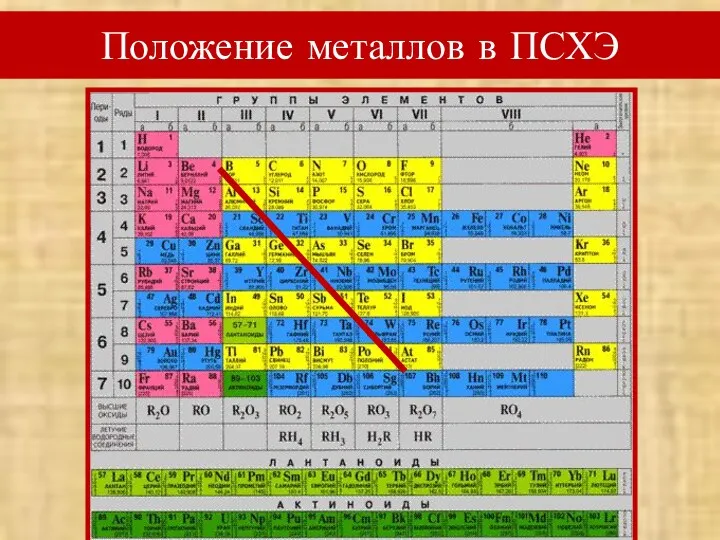
- 2. Положение металлов в ПСХЭ
- 3. Вывод: Атомы металлов – ……………. электроны с внешнего энергетического уровня, поэтому являются ……………………….. отдают восстановителями
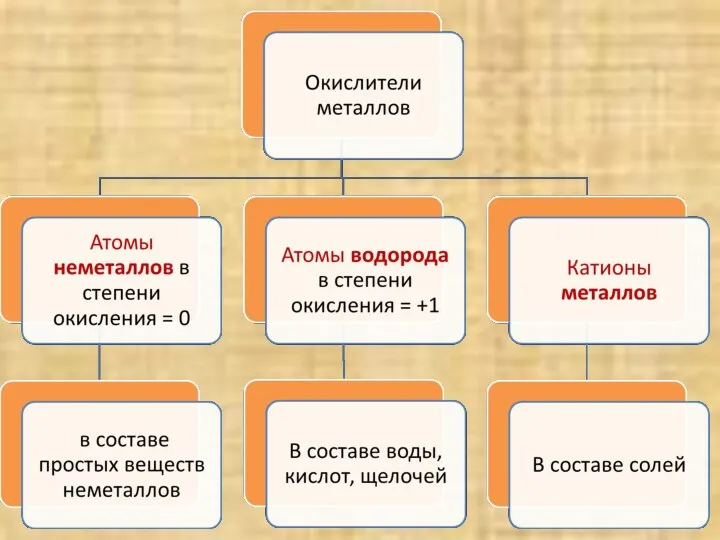
- 4. Атомы металлов – восстановители, а катионы металлов? Катионы металлов принимают электроны, и являются окислителями
- 6. Металлы взаимодействуют С неметаллами с образованием бинарных соединений (оксидов, гидридов, сульфидов, галогенидов и др.) С водой
- 7. Электрохимический ряд напряжений металлов.
- 8. 4 правила ЭХРНМ 1. Чем левее стоит металл в ЭХРНМ тем более сильным восстановителем он является
- 9. Металлы после водорода… Взаимодействие с концентрированной серной кислотой при нагревании Cu + 2H2SO4 = CuSO4 +
- 10. Металлы после водорода… Взаимодействие с концентрированной и разбавленной азотной кислотой. Опыт - 4 Cu + 4HNO3
- 11. Металлы после водорода… 3. Взаимодействие золота с «царской водкой» Au + HNO3 + 4HCl = H[AuCl4]
- 12. Подведем черту… Металл + кислород = оксид металла Металл + хлор = хлорид металла Металл +
- 13. Подведем черту… Металл + серная кислота (к) = соль + вода + «Х», где «Х» -
- 14. Напишите реакции: калий + вода = гидроксид калия + водород кальций + вода = гидроксид кальция
- 15. железо + соляная кислота = хлорид железа (II) + водород никель + серная кислота = сульфат
- 16. железо + сульфат меди (II) = медь + сульфат железа (II) медь + нитрат ртути (II)
- 17. Диагностика Напишите реакции взаимодействия магния с кислородом, хлором, азотом, водой, соляной кислотой, хлоридом меди(II) Напишите реакцию
- 19. Скачать презентацию














 топ през
топ през Благородные металлы
Благородные металлы Полимеры, бумага
Полимеры, бумага Анализ раствора кальция хлорида 5%-200 мл
Анализ раствора кальция хлорида 5%-200 мл Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Магний и кальций
Магний и кальций Вода. 8 класс
Вода. 8 класс Гидролиз солей. Лекция №9
Гидролиз солей. Лекция №9 Кислородные соединения серы. 2 часть
Кислородные соединения серы. 2 часть Переходные элементы
Переходные элементы Деструктивные процессы переработки нефти
Деструктивные процессы переработки нефти Складання рівнянь окисно-відновних реакцій. Метод електронного балансу
Складання рівнянь окисно-відновних реакцій. Метод електронного балансу Законы химии
Законы химии Plastic is one of the challenges of the 21st century
Plastic is one of the challenges of the 21st century Методы определения механических свойств полимерных композиционных материалов
Методы определения механических свойств полимерных композиционных материалов Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение Энергетика химических процессов. Термодинамика. (Лекция 4)
Энергетика химических процессов. Термодинамика. (Лекция 4) Циклоалканы. 10 класс
Циклоалканы. 10 класс Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік
Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік Сера и ее соединения
Сера и ее соединения Термохимия. Расчет тепловых эффектов химических реакций
Термохимия. Расчет тепловых эффектов химических реакций Реакции SR в ряду алканов
Реакции SR в ряду алканов Классификация химических реакций. 8 класс
Классификация химических реакций. 8 класс Спирты, фенолы, тиолы
Спирты, фенолы, тиолы Оксиды. 8 класс
Оксиды. 8 класс Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Природный и попутный нефтяной газы
Природный и попутный нефтяной газы Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение)