Содержание
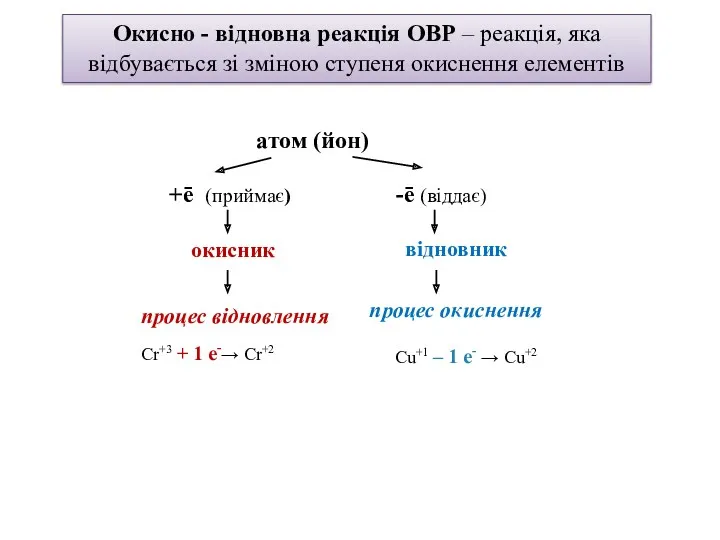
- 2. Окисно - відновна реакція ОВР – реакція, яка відбувається зі зміною ступеня окиснення елементів атом (йон)
- 3. Приклад 1 Розставте коефіцієнти методом електронного балансу, визначте окисник і відновник, укажіть процеси окиснення й відновлення
- 4. Приклад 2 KClO3 + S → KCl + SO2 2 3 +1 +5 -2 +1 -1
- 5. +2 0 Cu + 2ē → Cu CuCl2 + Al → AlCl3 + Cu 0 0
- 6. +6 0 W + 6ē → W WO3 + H2 → W + H2O 0 0
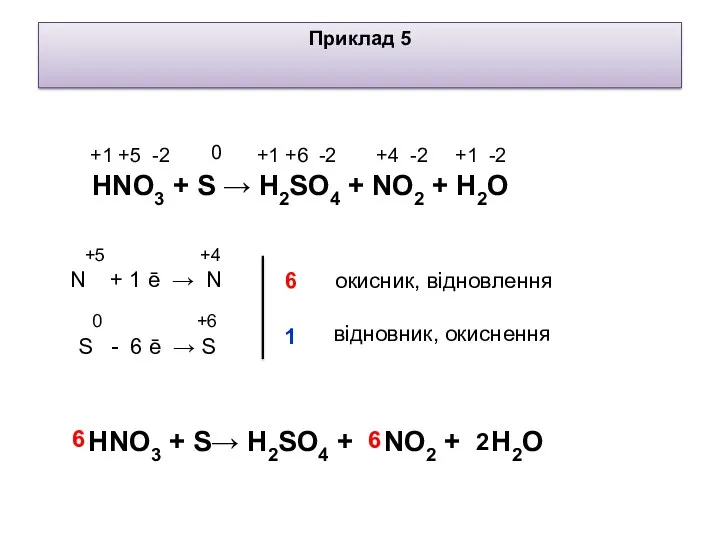
- 7. +5 +4 N + 1 ē → N 0 +4 -2 +1 +5 -2 Приклад 5
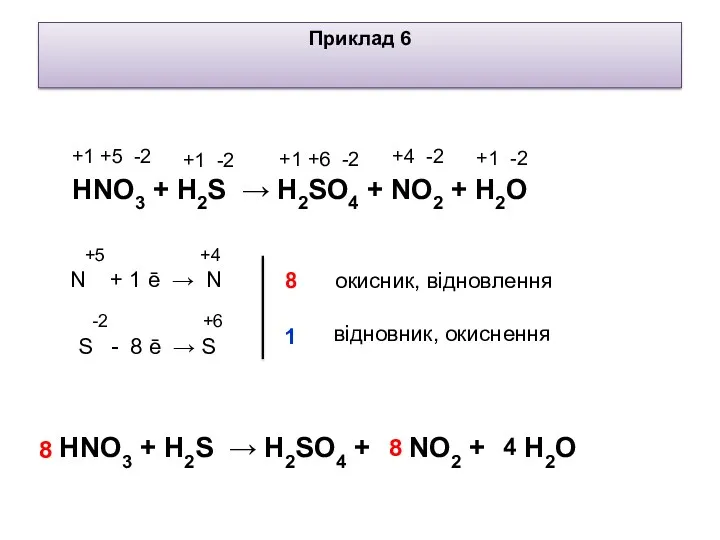
- 8. +5 +4 N + 1 ē → N +4 -2 +1 +5 -2 Приклад 6 -2
- 10. Скачать презентацию




 Сероводород. Сульфиды
Сероводород. Сульфиды Классификация и номенклатура органических соединений
Классификация и номенклатура органических соединений Пены. Пенообразование
Пены. Пенообразование Химические реакции. Классификация
Химические реакции. Классификация Введение. Теория строения органических соединений А.М.Бутлерова. Лекция № 1
Введение. Теория строения органических соединений А.М.Бутлерова. Лекция № 1 Кислород и оксиген
Кислород и оксиген Періодична система хімічних елементів
Періодична система хімічних елементів Изотопная геохимия
Изотопная геохимия Періодична система хімічних елементів. Хімія. 8 клас
Періодична система хімічних елементів. Хімія. 8 клас Второй закон термодинамики. Биоэнергетика
Второй закон термодинамики. Биоэнергетика Геохимия литосферы
Геохимия литосферы Титриметрический метод анализа
Титриметрический метод анализа Природные источники углеводородов
Природные источники углеводородов Неметаллические конструкционные материалы
Неметаллические конструкционные материалы Бинарные соединения АхБу. Номенклатура бинарных соединений
Бинарные соединения АхБу. Номенклатура бинарных соединений Польза и вред химического производства
Польза и вред химического производства Physiology lab
Physiology lab Химическая стойкость тугоплавких металлов в различных реагентах
Химическая стойкость тугоплавких металлов в различных реагентах Химический состав клетки. Неорганические вещества клетки. Урок 1
Химический состав клетки. Неорганические вещества клетки. Урок 1 Кислоты. Яблочная кислота
Кислоты. Яблочная кислота Классификация химических реакций в органической химии
Классификация химических реакций в органической химии Состояние и свойства воды
Состояние и свойства воды Карбоновые кислоты и их гетерофункциональные производные
Карбоновые кислоты и их гетерофункциональные производные Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування
Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування Валентность химических элементов. 8 класс
Валентность химических элементов. 8 класс Контроль качества лекарственных средств производных спиртов и альдегидов
Контроль качества лекарственных средств производных спиртов и альдегидов Реакционные аппараты
Реакционные аппараты Структурная химия и кристаллохимия
Структурная химия и кристаллохимия