Содержание
- 2. РЕАКЦИИ С УЧАСТИЕМ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Подчиняются тем же законам (закон сохранения массы и энергии, закон действующих
- 3. ПО ТЕПЛОВОМУ ЭФФЕКТУ Экзотермические реакции (+Q) – реакции, протекающие с выделением энергии во внешнюю среду. Эндотермические
- 4. ПО НАПРАВЛЕНИЮ Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях. Необратимые реакции протекают
- 5. ПО ФАЗОВОМУ СОСТОЯНИЮ Гетерогенные реакции – реакции, в которых реагирующие вещества и продукты реакции находятся в
- 6. ПО НАЛИЧИЮ КАТАЛИЗАТОРА: Каталитические – это реакции, протекающие в присутствии катализатора. Некаталитические – это реакции, протекающие
- 7. ОРГАНИЧЕСКИЕ РЕАКЦИИ ПРИНЯТО КЛАССИФИЦИРОВАТЬ по механизмам протекания Под механизмом реакции понимают последовательность отдельных стадий протекания реакций
- 8. По механизму реакции: Гомолитические (радикальные) реакции R – это реакции, идущие с образованием радикалов (частиц с
- 9. Радикальные реакции имеют цепной механизм, включающий стадии: зарождения, развития и обрыв цепи (свободнорадикальные цепные реакции): Зарождение
- 10. ПО МЕХАНИЗМУ РЕАКЦИИ: 2. Гетеролитические (ионные или электрофильно-нуклеофильные) реакции – это реакции, происходящие без разрыва электронных
- 11. ЭЛЕКТРОФИЛЬНЫЕ РЕАГЕНТЫ 1. Сильные: H+, Me+, HgCl+, FeCl2+, AlCl3, FeBr3, SbCl5, BF3, ZnCl2 и другие частицы,
- 12. 2. слабые: молекулы, обладающие небольшим сродством к электрону, которое может быть повышено образованием комплексов с сильными
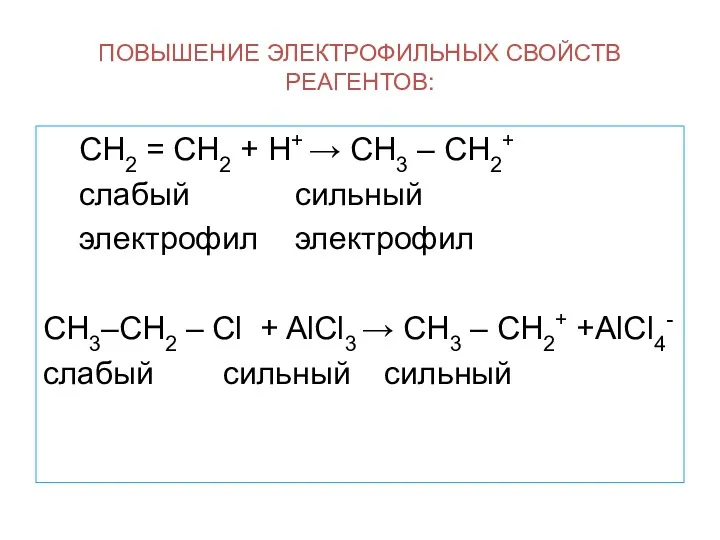
- 13. ПОВЫШЕНИЕ ЭЛЕКТРОФИЛЬНЫХ СВОЙСТВ РЕАГЕНТОВ: СН2 = СН2 + Н+ → СН3 – СН2+ слабый сильный электрофил
- 14. НУКЛЕОФИЛЬНЫЕ РЕАГЕНТЫ: Сильные нуклеофилы: к ним относятся :ОН− , анионы с высоким сродством к протону (основания);
- 15. СЛАБЫЕ НУКЛЕОФИЛЫ: К ним относятся анионы, являющиеся остатками сильных кислот: Сl− , Br−, HSO3(−), NO3(−), CNS(−),
- 16. Гетеролитические (ионные или электрофильно-нуклеофильные) реакции А) Нуклеофильные реакции N – реакции с нуклеофильными реагентами (анионами или
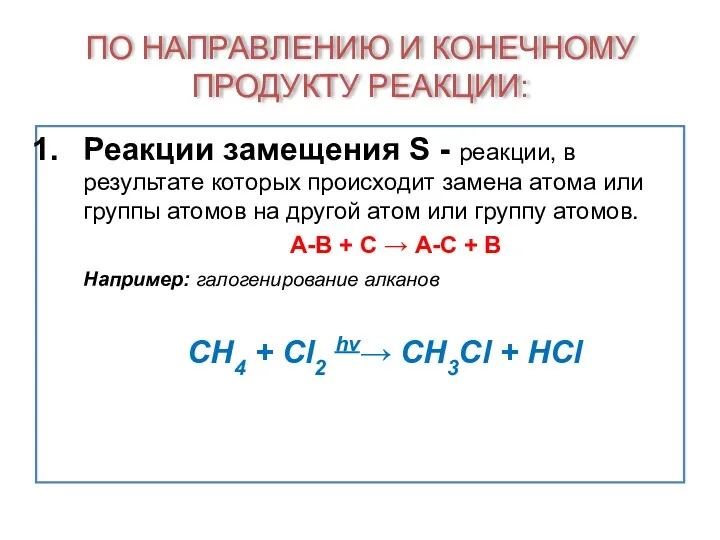
- 17. ПО НАПРАВЛЕНИЮ И КОНЕЧНОМУ ПРОДУКТУ РЕАКЦИИ: Реакции замещения S - реакции, в результате которых происходит замена
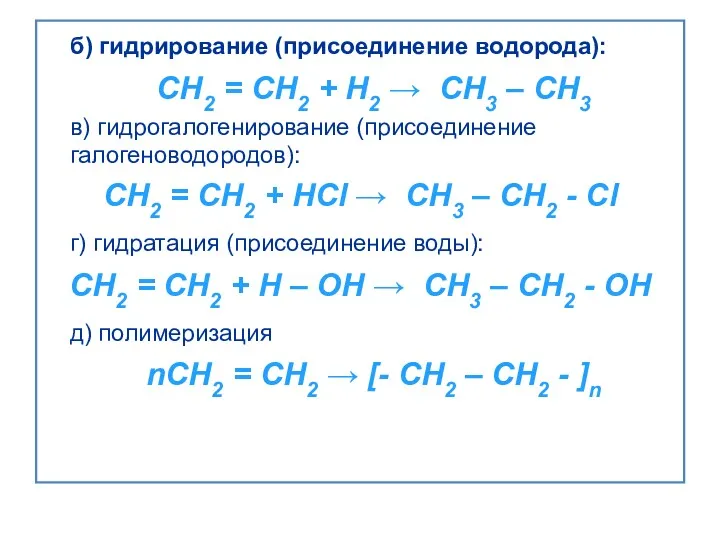
- 18. ПО НАПРАВЛЕНИЮ И КОНЕЧНОМУ ПРОДУКТУ РЕАКЦИИ: 2. Реакции присоединения А – реакции, в результате которых происходит
- 19. б) гидрирование (присоединение водорода): CH2 = CH2 + H2 → CH3 – CH3 в) гидрогалогенирование (присоединение
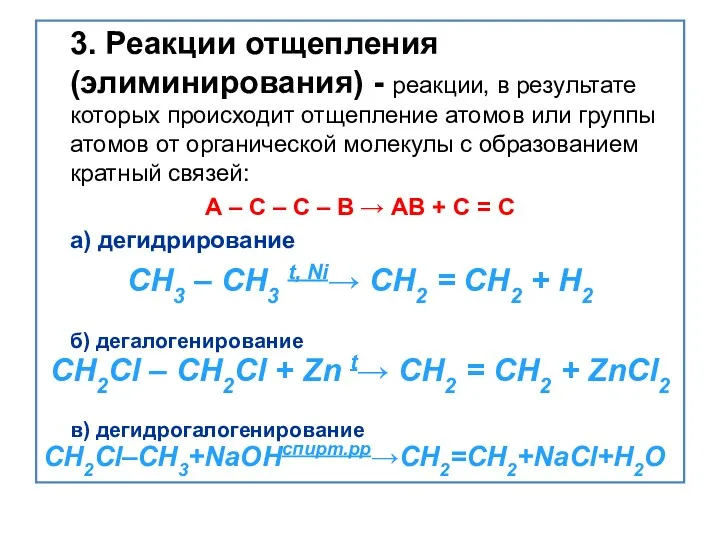
- 20. 3. Реакции отщепления (элиминирования) - реакции, в результате которых происходит отщепление атомов или группы атомов от
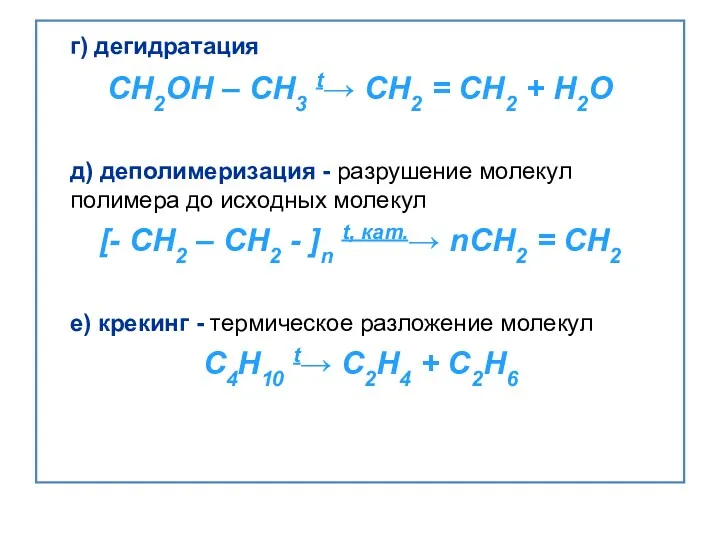
- 21. г) дегидратация CH2OH – CH3 t→ CH2 = CH2 + H2O д) деполимеризация - разрушение молекул
- 22. 4. Реакции перегруппировки (изомеризации) - реакции, в результате которых происходит перегруппировка атома или группы атомов в
- 23. 5. Реакции окисления и восстановления - реакции, в результате которых происходит изменение степени окисления атома углерода
- 24. Реакции окисления - взаимодействие органического вещества с более ЭО элементом (галогеном, кислородом и др.), при этом
- 26. Скачать презентацию


















 Метод МО
Метод МО Полімери та їх властивості
Полімери та їх властивості Урок + презентация Азот. 9 класс.
Урок + презентация Азот. 9 класс. Общие свойства кислот
Общие свойства кислот Соединения галогенов
Соединения галогенов Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей Химическая промышленность
Химическая промышленность Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы Материаловедение как наука
Материаловедение как наука Предельные углеводороды
Предельные углеводороды Карбоновые кислоты
Карбоновые кислоты Азот. Фосфор
Азот. Фосфор Синтетические органические вещества
Синтетические органические вещества Единый государственный экзамен Химия 2021. Задание 3
Единый государственный экзамен Химия 2021. Задание 3 Химический состав клетки
Химический состав клетки Шкала рН. Лекция 03-1
Шкала рН. Лекция 03-1 Organic Compounds
Organic Compounds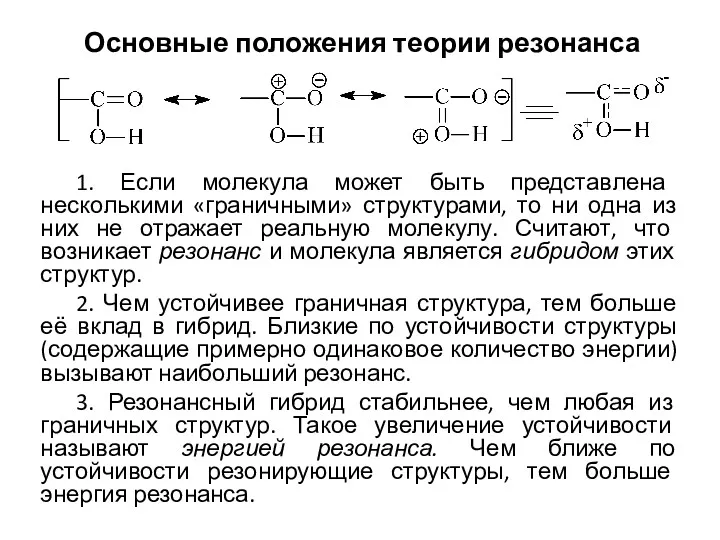 Основные положения теории резонанса
Основные положения теории резонанса Водород и его свойства
Водород и его свойства Изомерия биоорганических соединений. Структура и функции биолекул
Изомерия биоорганических соединений. Структура и функции биолекул Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Взрывоопасные грузы
Взрывоопасные грузы Гидролиз солей
Гидролиз солей Тіршілік гетерофункционалды қосылыстар
Тіршілік гетерофункционалды қосылыстар Полипропилен. Молекулалық құрылымы
Полипропилен. Молекулалық құрылымы Химические реакции. (8 класс)
Химические реакции. (8 класс) Химическая связь 11 класс ионная связь
Химическая связь 11 класс ионная связь Электролитическая диссоциация
Электролитическая диссоциация